Benutzer:Roland.chem/Basteln
Säure-Base-Reaktion[Bearbeiten | Quelltext bearbeiten]
J. N. Brønsted und T. Lowry definierten 1923 unabhängig voneinander Säure und Base als Reaktionspartner in einer chemischen Reaktion bei der Protonen (H+) ausgetauscht werden. Säure ist hier das Teilchen, welches in einer Gleichgewichtsreaktion ein Proton an einen Reaktionspartner, der so genannte Base, überträgt. Die Säure wird durch die Abgabe des Protons selbst zu einer Base und die Base, welche das Proton aufgenommen hat, wird zu einer Säure. Eine Säure wird auch Protonendonator, eine Base Protonenakzeptor genannt. Freie Protonen (H+-Teilchen) existieren hier zu keinem Zeitpunkt. Teilchen in solchen Reaktionen, die sich nur durch die An- oder Abwesenheit eines Protons unterscheiden, werden korrespondierendes oder auch konjugiertes Säure-Base-Paar genannt.
Im Gegensatz zu einer engen Definition von Säuren und Basen, die bestimmte Stoffklassen bilden, definieren sich hier über die Rolle, die sie bei einer chemische Reaktion spielen. Aus der Perspektive von Brønsted und Lowry wird ein Reaktionstyp, die Säure-Base-Reaktion beschrieben. Anstelle der mehrdeutigen Begriffe Säure und Base sollten hier die Begriffe Protonenakzeptor und Protonendonator verwendet werden. Bei Reaktionen in Wasser führt ein Protonendonator nicht unbedingt zu einer sauren Lösung, ein Protonenakzeptor nicht unbedingt zu einer basischen (alkalischen) Lösung, was im engen Sinne von chemischen Verbindungen die Säure bzw. Base genannt werden, zu erwarten ist. Dieses Modell bietet keine Prognose für das chemische Verhalten von bestimmten Stoffen oder Teilchen. Da jedoch Wasser eine besondere, praktische Bedeutung als Lösemittel hat, dient es als Referenzlösemittel für die zahlreichen Protonenübertragungsreaktionen.
Reaktion[Bearbeiten | Quelltext bearbeiten]
Allgemein kann eine Säure-Base-Reaktion in Analogie zu Redoxreaktionen in Teilrektionen (Säure-Base-Halbsysteme) zerlegt werden. Säure-Base-Reaktionen sind sehr schnelle Reaktionen und Gleichgewichte stellen sich in der Regel schnell ein. [Anmerkung 1] [1]
| Säure-Base-Reaktion |
|
| Teilreaktion des Säure-Base-Paares I |
|
| Teilreaktion des Säure-Base-Paares II |
|
Eigendissoziation[Bearbeiten | Quelltext bearbeiten]
Solche Gleichgewichtsreaktionen liegen beispielsweise in reinem Wasser, flüssigen, wasserfreien Ammoniak, wasserfreien Schwefelsäure, wasserfreien Ethanol, sowie in wasserfreier Essigsäure vor:
| Säure-Base-Reaktion (Eigendissoziation) | Ionenprodukt [2] | Neutralpunkt [2] |
| 10-14 | 7 | |
| 10-29 | 14,5 | |
| 10-4 | 2 | |
| 10-20 | 10 | |
| 10-13 | 6,5 |
Solche Reaktionen von Stoffen mit sich selbst werden Eigendissoziation oder Autoprotolyse genannt. Für Wasser lässt sich die Lage des Gleichgewichts durch das Ionenprodukt des Wassers KW beschreiben, wobei c für die Konzentration der Komponenten steht:
In einer allgemeiner Form gilt für die Reaktionen:
Als charakteristische Grösse einer solchen Reaktion wird häufig der Neutralpunkt angegeben. Dies ist möglich, da in solchen Reaktionen cs immer gleich cb sind.
Ionenprodukt und Neutralpunkt von solchen Reaktionen sind von der Temperatur abhängig. In der Regel werden Werte bei Raumtemperatur angegeben. Bei Wasser ist der Neutralpunkt 7, also der pH-Wert von reinem Wasser bei 22 °C. Die Konzentrationen von H3O+ und OH− sind jeweils 10−7 mol · l−1, also sehr klein.
Säure-Base-Reaktionen in protischen Lösungsmitteln[Bearbeiten | Quelltext bearbeiten]
Die oben genannten Verbindungen werden zu protischen Lösungsmitteln, wenn andere protische Stoffe zugesetzt werden. Ist das Lösemittel Wasser, nennt man chemische Verbindungen (in klassischem Sinne) Säuren bzw. Basen, wenn Sie zu einer sauren (pH < 7) bzw. basischen (pH > 7) Lösung führen. Diese Verbindungen lassen sich in Bezug zu ihrer Reaktion mit Wasser in sehr schwache bis sehr starke Säuren bzw. Basen einteilen und ihre Stärke genauer durch die Säurekonstante (Ks) beschreiben. Analog zur Säurekonstante kann für ein konjugiertes Säure-Base-Paar auch eine Basenkonstante (Kb) angegeben werden, die in wässrigen Lösungen untereinander verknüpft ist:
- oder als dekadischer Logarithmus:
Einige Stoffe sind in unten in einer Tabelle (der protochemischen Spannungsreihe) aufgelistet und nach Stärke eingeteilt. Bedeutsam ist die Trennung zwischen sehr starken und weniger starken Säuren bzw. Basen. [Anmerkung 2]
Sehr starke Säuren und Basen im Vergleich zum Lösemittel[Bearbeiten | Quelltext bearbeiten]
Bei sehr starke Säuren und Basen kommt zu einer Nivellierung (auch: nivellierender Effekt, engl.: levelling effect) durch das jeweilige protische Lösemittel. In wässrigen Lösungen liegen beispielsweise nur H3O+, H2O und OH− als Protonendonator bzw. Protonenakzeptor vor. Die eigentliche Verbindungen, die zur Bildung dieser Teilchen geführt haben, spielen aus der Perspektive einer Säure-Base-Reaktion keine wesentliche Rolle mehr. Sie sind „Reste“ von chemischen Verbindungen, die man als Säuren bzw. Basen bezeichnet. Aus dieser Perspektive kann man hier von Säurerest bzw. Basenrest sprechen. Die eigentlichen Säure-Base-Reaktionen im Sinne von Brønsted und Lowry sind in Wasser
- bzw.
und analog dazu in flüssigem Ammoniak:
Bestimmte Teilchen sind jedoch in großer Menge vorhanden, was eine Reaktionsgleichung nicht wiedergibt. Durch sehr starken Säuren und Basen bilden sich saure bzw. basische Lösungen, bei denen in wässrigen Systemen der pH-Wert die gesamte Konzentration an Protonendonatoren und Protonenakzeptoren widerspiegelt.
Werden Lösungen von sehr starke Säuren mit Lösungen von sehr starken Basen in geeigneter Menge zusammengefügt, führt dies zu einer Neutralisation der Lösung. Wird beispielsweise Natronlauge mit einer geeigneten Menge an Salzsäure versetzt, bildet sich eine Lösung, die einer Lösung von Natriumchlorid in Wasser entspricht. Aus der Perspektive von Säure-Base-Reaktionen bleibt nur die Eigendissoziation von Wasser mit einem pH-Wert von 7 zurück.
- Beispiele
Wird das Lösemittel Wasser oder flüssiges Ammoniak mit Perchlorsäure versetzt, laufen folgende Reaktionen ab:
in Wasser: in Ammoniak:
ähnliches geschieht mit Chlorwasserstoff:
in Wasser: (Diese Lösung nennt man Salzsäure) in Ammoniak: (Es bildet sich gelöstes Ammoniumchlorid)
Natriumamid bildet
- in Wasser:
- in Wasser: (Es bildet sich Natronlauge)
Die hier aufgeführten Reaktionen laufen weitestgehend nach rechts ab. Die „Reste“ ClO4−, Cl− und Na+ reagieren weder als Protonendonator, noch als Protonenakzeptor. Sie sorgen jedoch für eine ausgeglichene Ladungsbilanz der Ionen.
Schwächere Säuren und Basen im Vergleich zum Lösemittel[Bearbeiten | Quelltext bearbeiten]
Schwächere Säuren und Basen spielen bei Säure-Base-Reaktionen in protischen Lösungsmitteln eine breitere Rolle als die Starken. Die hier genannten Teilchen sind alle an der jeweiligen Gleichgewichtseaktion beteiligt:
Essigsäure in Wasser: Schwefelwasserstoff in Wasser: Ammoniak in Wasser: Die Lösung wird Ammoniumhydroxid genannt.
(In wässriger Lösung bildet NH3 kein NH2−, da dieses Teilchen eine sehr starke Base ist.)
pH-Werte beschreiben die Eigenschaften solcher Lösungen unvollständig. Neben den H3O+, bzw. den OH−-Ionen liegen noch andere Protonendonatoren bzw. Protonenakzeptoren in vergleichsweise grossen Konzentrationen vor. Gelegentlich wird von einer potentiellen Acidität bzw. potentiellen Basizität gesprochen. Die Bildung von Donatoren bzw. Akzeptoren durch die Autoprotolyse des Lösungsmittels ist vergleichsweise sehr gering und braucht daher nicht berücksichtigt zu werden.
Protolysegleichgewichte von mittelstarken und schwachen Donatoren bzw. Akzeptoren lassen sich mit der Henderson-Hasselbalch-Gleichung beschreiben. Teilweise Umsetzung solcher Teilchen mit sehr starken Säuren bzw. Basen führt zu pH-Puffersystemen (Pufferlösungen), wie zum Beispiel der Essigsäure-Acetat-Puffer. Solche Puffer spielen wichtige Rollen in der Natur, wie beim Blutpuffer oder bezüglich den Auswirkungen des sauren Regens.
Abweichend von der Umsetzung von Lösungen sehr starken Säuren mit Lösungen sehr starken Basen führen Reaktionen von sauren und basischen Lösungen unterschiedliche starker Säuren bzw. Basen nicht unbedingt zu einer neutralen Lösung bei der nur Salze und Wasser zurückbleiben. Wird eine saure Lösung von Chlorwasserstoff (die Salzsäure) mit der basischen Lösung von Natriumacetat umgesetzt, bildet sich Essigsäure:
- (Umsetzung)
Bei vollständiger Umsetzung der Acetat-Ionen bildet sich keine neutrale, sondern eine saure Lösung. Es stellt sich ein Gleichgewicht ein, dass der Gleichgewichtsreaktion von Essigsäure in Wasser entspricht.
- (Gleichgewicht)
Die veraltete Aussage, das die Umsetzung einer "Säure" mit einer "Base" zu einem Salz führen würde, ist hier offensichtlich nicht richtig. In der Lösung liegt zwar eine Lösung von Natriumchlorid vor, aus der Perspektive einer Säure-Base-Reaktion haben sie jedoch nicht an der Reaktion teilgenommen. In der Reaktion haben Cl– und Na+ als formale Reste sehr starker Säuren (HCl) bzw. Basen (NaOH) keine Bedeutung.
Jede Einteilung in sehr starke und starke Säuren und Basen bezieht sich auf das jeweilige protische Lösemittel. In flüssigen Ammoniak reagiert Essigsäure als sehr starke Säure. Das Acetat-Ion spielt hier als Protonenakzeptor keine Rolle.
Reaktionen von mehrprotonige Säuren in Wasser[Bearbeiten | Quelltext bearbeiten]
Als mehrprotonige Säuren werden Verbindungen bezeichnet, die prinzipiell zwei oder mehrere Protonen an einen Reaktionspartner übertragen können. Da nach der Übertragung eines oder mehrerer Protonen die jeweilig zurückbleibenden Teilchen auch als Protonenakzeptor reagieren kann, werden die Säuren auch mehrbasige Säuren genannt. Die Säurekonstanten K der mehrprotonige Säuren fallen mit jedem Schritt der Protonenabgabe: Ks1 > Ks2 > Ks3 ... .
In Wasser reagiert die zweiprotonige Säure Schwefelsäure im ersten Schritt der Säure-Base-Reaktion als sehr starke Säure und überträgt ihr erstes Proton vollständig auf Wassermoleküle.

- (1)
Das Teilchen HSO4− ist schwächer und nur noch ein starker Protonendonator, daher stellt sich ein Gleichgewicht mit Wasser ein.
- (2)

Bei einer Reaktion der dreiprotonigen Säure Orthophosphorsäure mit Wasser stellt sich schon bei der ersten Säure-Base-Reaktion ein Gleichgewicht ein, da sie nur eine starke Säure ist.
- (1)
H2PO4− ist nur ein mittelstarker Protonendonator, HPO42− nur noch ein schwacher Protonendonator. Die Säure-Base-Reaktionen
- (2)
- (3)
finden jedoch bei der Reaktion von Orthophosphorsäure in Wasser nicht statt, da sie zu schwach sind. Wird der sauren Lösung jedoch eine Lösung einer sehr starken Base (z.B. Natronlauge) versetzt, fällt die Konzentration der H3O+-Teilchen (der pH-Wert sinkt) und die beiden unteren Säure-Base-Reaktionen gewinnen an Bedeutung. Die Abbildung rechts zeigt den Zusammenhang zwischen pH-Wert und der jeweilig stattfindenden Säure-Base-Reaktion.
- Alternative: 1:1-Mischung von Natriumdihydrogenphosphat und Dinatriumhydrogenphosphat , Rkt (2), pH-Wert = 7, Prototyp einer Puffersystems
Säure-Base-Reaktionen von Salzen[Bearbeiten | Quelltext bearbeiten]
Nach dem Modell von Brønsted und Lowry lassen sich zwanglos saure und basische Reaktionen einordnen, die beim Lösen von anorganischen Salzen in Wasser auftreten können.
Eine wässrige Lösung von Natriumcarbonat (Na2CO3) führt zu einer basischen Lösung (pH-Wert < 7):
- (Lösungsvorgang)
- (Säure-Base-Reaktion)
Aluminiumchlorid in Wasser lässt eine saure Lösung (pH-Wert < 7) entstehen. Beim Lösen des Salzes bildet sich der Hexaaqua-Komplex [Al(H2O)6]3+. Dieser Komlex reagiert in einer Säure-Base-Reaktion.
- (Lösungsvorgang)
- (Säure-Base-Reaktion)
Auch wässrige Lösungen von Salze der mehrprotonigen Säuren gehen Säure-Base-Reaktionen ein. Dinatriumhydrogenphosphat bildet in Lösung das Hydrogenphosphat-Anion, das einer Säure-Base-Disproportionierung unterliegt und als Protonenakzeptor oder Protonendonator reagieren kann. (Siehe auch Ampholyte).
- (Lösungsvorgang)
- (Säure-Base-Reaktion)
HPO42− ist eine mittelstarke Base, die Lösung ist daher basisch. Die Disproportionierung findet nur in sehr kleinem Mengen statt.
Das Brønstedsche Säure-Base-Konzept bietet keine Vorhersagen zur potentiellen Löslichkeit von Salzen, also die Hydratisierung ihrer Ionen, sowie keine Prognose über mögliche hydrolytischen Reaktionen der Aquakomplexe. Hier reicht das Konzept nach Lewis und das HSAB-Konzept weiter.
Ammoniumacetat setzt in Lösung NH4+ als Säure und Ac− als Base frei. Es stellen sich verschiedene Gleichgewichte ein:
(Lösungsvorgang) (Säure-Base-Reaktion I) (Säure-Base-Reaktion II) (Säure-Base-Reaktion III) (Gesamtreaktion)
Da in diesem Fall die Stärken gleich gross sind (pKs=9,25 (NH4+), pKb=9,25 (Ac−)) liegt eine neutrale (pH=7) Lösung vor. Die Lösung unterscheidet sich von reinem Wasser bzw. einer Lösung von Natriumchlorid, da eine pH-Puffer-Lösung vorliegt.
Genauere Betrachtung[Bearbeiten | Quelltext bearbeiten]
Stärke von Säuren und Basen[Bearbeiten | Quelltext bearbeiten]
Die Stärke von Säuren und Basen in verdünnten, wässrigen Lösungen lassen sich durch Konstanten beschreiben. Für die Säurekonstante gilt:
- und
Für die Basenkonstante gilt
- und
Die Konstanten sind eigentlich Gleichgewichtskonstanten von chemischen Reaktionen von Säuren bzw. Basen bei ihrer Umsetzung mit Wasser. Da hier nur Reaktionen mit Wasser im grossen Überschuss betrachtet werden und seine Konzentration praktisch kaum abnimmt, ist das Edukt (Ausgangsstoff) Wasser in die Konstanten eingerechnet. Im Nenner der Gleichungen steht nur noch die Konzentration des Ausgangsstoffs, die im Gleichgewicht noch vorliegt. Im Zähler finden sich die Konzentrationen der Produkte der protolytischen Reaktion. Streng genommen sind die alle Werte auf eine Standardkonzentration von 1 mol·l−1 normiert. Damit sind sie dimensionslos und Ks und Kb haben keine Einheiten. Die Konzentrationen der Produkte des Wasser werden häufig auch in der Form
- oder
angegeben.
Die Protochemischen Spannungsreihe vergleicht die protochemischen Normalpotentiale, also die pKs- und pKb-Werte diverser Säure-Base-Systeme. Die Acidität bzw. Basizität (der pH-Wert) der Lösung eines Säure-Base-Systems hängt vom Normalpotential und von den Konzentrationen ab. pH = pKs gilt nur für den Fall, dass die Protonenabzeptoren und Protonendonatoren in gleichen Konzentrationen vorliegen. Eine Auflistung von Basenkonstanten sind nicht unbedingt notwendig, da die Konstanten eines konjugierten Säure-Base-Paares miteinander verknüpft sind:
- bzw.
Die Basenkonstanten beschreiben jedoch überschaubarer chemischen Reaktionen, die zur Bildung von Hydroxidionen führen.
Die Konzentration der Protonendonatoren bzw. der Protonenakzeptoren im Gleichgewicht werden häufig in Gleichungen als c(Säure), c(Base) angegeben. Mit C(Säure) und C(Base) werden die Gesamtkonzentation bzw. die formalen Ausgangskonzentrationen einer Säure bzw. einer Base angegeben. Hier sind mit Säure und Base chemische Verbindungen gemeint, die (gedanklich oder real) in bestimmter Menge in ein bestimmtes Volumen Wasser gegeben werden.
Protolysegrad[Bearbeiten | Quelltext bearbeiten]
| Grenzen der Näherung des Protolysegrades [3] für Fehler bis 1 % | |
| C(Säure) (mol·l−1) | für pKs Werte |
| 1 | 4 bis 12 |
| 0,1 | 5 bis 11 |
| 0,01 | 6 bis 10 |
| 0, 001 | 7 bis 9 |
| 0,0001 | 8 |
Der Protolysegrad α (auch Dissoziationsgrad genannt) gibt das Verhältnis der durch Säure-Base-Reaktion gebildete Base- bzw. Säure-Teilchen zur Gesamtkonzentration einer Säure bzw. Base in einer Lösung an. α ist immer < 1.
- und
Der Protolysegrad einer bestimmten Verbindung ist von der Temperatur abhängig und nimmt bei Verdünnung zu. Der Protolysegrad einer bestimmten Säure mit bekanntem pKs-Wert und bestimmter Temperatur ist nur vom pH-Wert der Lösung abhängt. Der pH-Wert einer solchen Lösung ist dabei selbst Abhängig von der Gesamtkonzentration C0 der Säure. Der Protolysegrad kann durch das Ostwaldsches Verdünnungsgesetz beschrieben werden.
Für schwache Säuren und Basen gilt die Näherung[3]:
- und
Beispiel: Der Protolysegrad von Cyanwasserstoff (HCN, Ks = 10−9,4) liegt bei einer 0,1 molaren wässrigen Lösung bei 6,3·10−5. Bei einer 0,01 molaren Lösung liegt α bei 2·10−4.
Verdünnte Lösungen sehr starker Säuren und Basen[Bearbeiten | Quelltext bearbeiten]
| Grenzen der Näherung [3] für Fehler ≤ 0,05 pH-Einheiten. | |
| für pKs Werte | C(Säure) (mol·l−1) |
| 0 | 10−1 bis 10−6 |
| 1 | 10−2 bis 10−6 |
| 2 | 10−3 bis 10−6 |
Bei verdünnte Lösungen von Lösungen von sehr starker Säuren und Basen lässt sich der pH-Wert der Lösungen leicht abschätzen. Für Säuren gilt:
Für Basen gilt:
- mit
Für Alkalihydroxide, wie Natriumhydroxid, die nach Brønsted als Salze zu betrachten sind, gilt analog:
Lösungen mittelstarker und schwachen Säuren und Basen[Bearbeiten | Quelltext bearbeiten]
| Grenzen der Näherung [3] | |
| C(Säure) (mol/l) | für pKs Werte |
| 1 | 3 bis 12 |
| 0,1 | 4 bis 11 |
| 0,01 | 5 bis 10 |
| 0, 001 | 6 bis 9 |
| 0,0001 | 7 bis 8 |
Da bei schwachen Säuren nur ein kleiner Bruchteil der Säure deprotoniert vorliegt, ist c(Säure) etwa gleich gross wie die formale Ausgangskonzentration der Säure (C(Säure)). Die Konzentration der sich bildenden Base (c(Base)) ist gleich der Konzentration der Oxoniumionen (c(H3O+)):
Beispiel: Bei einer 0,1 molaren Lösung von Ammoniumchlorid liegt der pH-Wert liegt bei 5,1. In der Lösung wirkt der Protonendonator NH4+ mit pKs = 9,25.
Für eine Base ergibt sich analog:
- mit
Beispiel: Bei einer 0,1 molare Lösung von Natriumacetat liegt der pOH-Wert bei 5,1 bzw. der pH-Wert bei 8,9. In der Lösung wirkt der Protonenakzeptor H3C-COO− mit pKb = 9,25.
Säure-Base-Gleichgewichte[Bearbeiten | Quelltext bearbeiten]
| Abschätzung[4] für einmolare Lösungen | |||||||
| ΔpKs | +6 | +4 | +2 | 0 | −2 | −4 | −6 |
| % Umsatz | 0.1 | 1 | 10 | 50 | 90 | 99 | 99.9 |
Liegen in einer wässrigen Lösung zwei Säure-Base-Paare HA/A− mit pKs1 und HB/B− mit pKs2 vor, stellt sich zwischen den Systemen ein Protolysegleichgewicht ein. Der Gesamtreaktion lässt sich mit einer Gleichgewichtskonstante ΔpKs beschreiben:
Ist ΔpKs nahe Null, liegt das Gleichgewicht in der Mitte, ist der Wert deutlich kleiner Null, liegt das Gleichgewicht auf Seite der Edukte und bei Werten grösser Null auf Seite der Produkte. Die Tabelle rechts zeigt Lage der Gleichgewichte (den Umsatz) für 1 molare Lösungen in Abhängigkeit von ΔpKs-Werten. Mit Hilfe von ΔpKs-Werten lässt sich Abschätzen, wie sich z.B. eine essigsaure Lösung verhält, die Chloridionen verhält:
Die Säurekonstante von Essigsäure ist 4,75, die Basenkonstante von Chlorid liegt bei etwa 20, woraus ein ΔpKs-Wert von 10,75 folgt. Das Gleichgewicht liegt sehr stark auf der Seite der Edukte; in verdünnten Lösungen ist nicht mit der Bildung von HCl zu rechnen. Wird eine essigsaure Lösung hingegen mit Ammoniak versetzt stellt sich das Gleichgewicht
ein. Die Basenkonstante von NH3 ist 4,75 und der ΔpKs-Wert liegt bei -4.5 und damit das Gleichgewicht deutlich auf der rechten Seite.
Für Salze, die aus schwachen Säuren und schwachen Basen zusammengesetzt sind, lässt sich der pH-Wert ihrer Lösung abschätzen. Es gilt die Näherung:
In dieser Gleichung wird der pKs-Wert des tatsächlich im Salz vorhandenen Protonendonator und der pKs-Wert der Säure, der dem im Salz vorhandenen Protonenakzeptor zugrunde liegt, verwendet.
Beispiel: Bei einer 0,1 molare Lösung von Ammoniumacetat liegt der pH-Wert bei 7. Der pKs-Wert für NH4+ liegt bei 9,25. Dem Acetat-Ion liegt die Essigsäure mit einem pKs-Wert von 4,75 zugrunde.
Protolysegleichgewichte in Abhängigkeit vom pH-Wert[Bearbeiten | Quelltext bearbeiten]
Säure- und Basenbruch[Bearbeiten | Quelltext bearbeiten]


| Abschätzung [5] | ||
| pH < pKs | pH > pKs | |
linear
log
Abschätzung für pKs − 1 ≤ pH ≤ pKs + 1
Isoelektrischer Punkt
XXX[Bearbeiten | Quelltext bearbeiten]
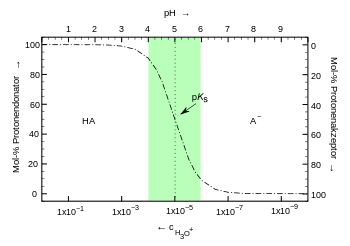
Solche Lösungen sind in der Natur verbreitet oder werden als Pufferlösungen hergestellt oder treten im Verlauf einer Säure-Base-Titration einer schwachen Säure oder Base auf.
Für die Säure-Base-Reaktion gilt im allgemeinen
In Wasser sind ProtonendonatorII bzw. ProtonenakzeptorII Wassermoleküle oder ihre protonierten bzw. deprotonierten Formen. ProtonendonatorI und ProtonenakzeptorI sind ein konjugiertes Säure-Base-Paar.
- oder
Beispiele
Unabhängig von dem Reaktionsprodukten des Wassers in der Reaktion gilt für mittelstarke, konjugierte Säure-Base-Paare die Henderson-Hasselbalch-Gleichung.
In den Beispielen sind die Protonendonatoren die Essigsäure (mit pKs = 4,75) bzw. das Ammonium-Ion NH4+ (mit pKs = 9,25). Liegen in der Lösung Protonendonator und -akzeptor im gleichen Konzentrationen vor, ist der pH-Wert gleich dem pKs-Wert. Eine 1:1 Lösung aus Natriumacetat/Essigsäure bildet eine säure Lösung mit dem pH 4,75. Eine Analoge Mischung aus Ammoniak und Ammoniumchlorid bildet eine basische Lösung mit dem pH 9,25.
- (z.B. Methylrot)
Hägg[Bearbeiten | Quelltext bearbeiten]
| Hägg-Diagramm |

|
| Hägg-Diagramm für Essigsäure und ihre Salze a) Durchgezogene Kurven für 0,1 molare Lösungen. b) Gestrichelte Kurven für 0,01 molare Lösungen. ––: Konzentration von HAc. ––: Konzentration von Ac−. A: Gleichgewichtslage einer 0,1 molaren Essigsäurelösung. B: Pufferpunkt mit pH= pKs = 4,75. C: Neutralpunkt (pH=7). D: Gleichgewichtslage einer 0,1 molaren Acetatlösung z.B. von Natriumacetat. |

|
| Hägg-Diagramm für 1 molare Lösungen der Phosphorsäure und ihren Salze. A: Gleichgewichtslage einer 1 molaren Phosphorsäurelösung. C: Gleichgewichtslage für 1 molare Lösung von Dihydrogenphosphaten (H2PO4−). F: Gleichgewichtslage für 1 molare Lösung von Hydrogenphosphaten (HPO42−). H: Gleichgewichtslage einer 1 molaren Phosphatlösung (PO43−). B, E, G = Pufferpunkte, E entspricht einer Lösung in die 0,5 mol/l NaH2PO4 und 0,5 mol/l Na2HSO4 gegeben wurde. |

|
| Glycin |
- in Wasser
- oder
Gleichgewichtslage[Bearbeiten | Quelltext bearbeiten]
- Säurekonstante, Basenkonstante, Die Lage des Gleichgewichts ... ,
- Protolyse
- saure Lösung, basische Lösung, K W = konst. = 1*10-14 mol/l,
- Pufferlösung, Protolysegleichgewichte / Protonenübertragungsreaktionen
- Besondere praktische Bedeutung als Lösemittel hat das Wasser.
- Massenwirkungsgesetz
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Hans-Rudolf Christen: Grundlagen der allgemeinen und anorganischen Chemie, Otto Salle, Frankfurt a. M. 1988, 9. Auflage, S. 371
- ↑ a b James E. Huheey: Anorganische Chemie: Prinzipien von Struktur und Reaktivität, de Gruyter, Berlin 1988, S. 309 ff. ISBN 3-11-008163-6.
- ↑ a b c d K.-H. Lautenschläger, W. Schröter, J. Teschner, H. Bibrack: Taschenbuch der Chemie, 18. Auflage, Harri Deutsch, Frankfurt a. M. 2001, S. 199
- ↑ A. F. Holleman, E. Wiberg: Lehrbuch der anorganischen Chemie, 91.–100. Auflage, de Gruyter, Berlin 1985, S. 245.
- ↑ Claus Bliefert: pH-Wert-Berechnungen, Verlag Chemie, Weinheim, 1978
Anmerkungen[Bearbeiten | Quelltext bearbeiten]
- ↑ Einfache Protonenübertragungsreaktionen laufen ohne Aktivierungsenergie ab. Die schnellen Reaktionen erreichen Geschwindigkeiten von 1011 mol · l−1 · s−1
- ↑ Werte der protochemische Spannungsreihe gelten für 1 molare wässrige Lösungen bei 25°C. Die Acidität bzw. Basizität eines Stoffes ist jedoch Abhängig von seiner Konzentration und der Temperatur. Da jedoch Wasser als Lösemittel eine hohe praktische und natürliche Bedeutung hat und gleichzeitig als Referenzlösemittel dient, genügt die Spannungsreihe häufig für eine qualitative Abschätzungen zahlreicher Protonenübertragungsreaktionen.
Literatur[Bearbeiten | Quelltext bearbeiten]
- James E. Huheey: Anorganische Chemie: Prinzipien von Struktur und Reaktivität, de Gruyter, Berlin 1988, S. 309 ff. ISBN 3-11-008163-6.
- A. F. Holleman, E. Wiberg: Lehrbuch der anorganischen Chemie, 91.–100. Auflage, de Gruyter, Berlin 1985, S. 232ff, ISBN 3-11-007511-3
- K.-H. Lautenschläger, W. Schröter, J. Teschner, H. Bibrack: Taschenbuch der Chemie, 18. Auflage, Harri Deutsch, Frankfurt a. M. 2001, S. 174ff, ISBN 3-8171-1654-3
Fragmente[Bearbeiten | Quelltext bearbeiten]

- mit c X : Konzentration von X, K XY: Ionenprodukt (bei Raumtemperatur), KW: Ionenprodukt des Wassers (bei 22 °C)
Dinatriumhydrogenphospat: pKs=12,36 (HPO42−), pKb=6,8 (HPO42−) , pH=9,78
Links[Bearbeiten | Quelltext bearbeiten]
Tabelle[Bearbeiten | Quelltext bearbeiten]
| Protochemische Spannungsreihe | |||||
|---|---|---|---|---|---|
| Säurestärke | pKs | Säure + H2O H3O+ + Base | pKb | Basenstärke | |
| sehr stark | −10 | HClO4 | ClO4− | 24 | sehr schwach |
| −10 | HI | I− | 24 | ||
| −9 | HBr | Br− | 23 | ||
| −6 | HCl | Cl− | 20 | ||
| −3 | H2SO4 | HSO4− | 17 | ||
| −1,32 | HNO3 | NO3− | 15,32 | ||
| 0 | H3O+ | H2O | 14 | ||
| stark | 1,92 | HSO4− | SO42− | 12,08 | schwach |
| 2,13 | H3PO4 | H2PO4− | 11,87 | ||
| 2,22 | [Fe(H2O)6]3+ | [Fe(OH)(H2O)5]2+ | 11,78 | ||
| 3,14 | HF | F− | 10,86 | ||
| 3,35 | HNO2 | NO2− | 10,65 | ||
| 3,75 | HCOOH | HCOO− | 10,25 | ||
| mittelstark | 4,75 | CH3COOH | CH3COO− | 9,25 | |
| 4,85 | [Al(H2O)6]3+ | [Al(OH)(H2O)5]2+ | 9,15 | ||
| 6,52 | H2CO3 | HCO3− | 7,48 | mittelstark | |
| 6,92 | H2S | HS− | 7,08 | ||
| 7 | HSO3− | SO32− | 7 | ||
| 7,20 | H2PO4− | HPO42− | 6,80 | ||
| 9,25 | NH4+ | NH3 | 4,75 | ||
| 9,40 | HCN | CN− | 4,60 | ||
| schwach | 10,40 | HCO3− | CO32− | 3,60 | stark |
| 12,36 | HPO42− | PO43− | 1,64 | ||
| 13,00 | HS− | S2− | 1,00 | ||
| sehr schwach | 14 | H2O | OH− | 0 | sehr stark |
| 15,90 | CH3CH2-OH | CH3-CH2-O− | −1,90 | ||
| 23 | NH3 | NH2− | −9 | ||
| 24 | OH − | O2− | −10 | ||
| 34 | CH4 | CH3− | −20 | ||
| Anmerkungen: Die Werte beziehen sich auf wässrige Lösungen mit c = 1 mol/l bei Raumtemperatur. Die pKs- und pKb-Werte des Wassers sind hier als Referenzpunkte zum Vergleich mit anderen Stoffen als 0 und 14 angegeben. | |||||






































![{\displaystyle \mathrm {AlCl_{3}+6\,H_{2}O\longrightarrow [Al(H_{2}O)_{6}]^{3+}+3\ Cl^{-}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/5a89574cfa3a82380992b7fb97cad950919d8a74)
![{\displaystyle \mathrm {[Al(H_{2}O)_{6}]^{3+}+H_{2}O\rightleftharpoons [Al(OH)(H_{2}O)]_{5}^{2+}+H_{3}O^{+}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/2bda8860f9360556f479b56c8f57e9be1fbef7c5)




























































![{\displaystyle \mathrm {A\longrightarrow X{\xrightarrow[{\leftarrow }]{}}B{\xrightarrow {\leftarrow }}C{\underset {\longrightarrow }{\leftarrow D}}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/8ea7b16260ad0e764426a0ed27a4e90d5193a797)




