Brincidofovir
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
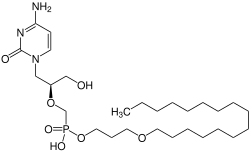
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Brincidofovir | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C27H52N3O7P | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 561,70 g·mol−1 | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Brincidofovir (synonym CMX001) ist ein experimentelles Virostatikum gegen verschiedene Viren und ein Derivat des Virostatikums Cidofovir.[2] Brincidofovir wurde während der Ebolafieber-Epidemie 2014 ohne die üblicherweise notwendige Arzneimittelzulassung an Menschen eingesetzt.[3]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Brincidofovir ist in Tierversuchen wirksam gegen das Herpes-simplex-Virus 1,[4] Kaninchenpocken-Virus,[5] Adenovirus (AdV),[6] BK-Virus, Pockenviren[7] und das Ebolavirus.[8] Brincidofovir wurde im Vergleich zu Cidofovir um ein Lipid verlängert, das innerhalb der Zelle abgespalten wird und zum aktiven Wirkstoff Cidofovir-Diphosphat verstoffwechselt wird.[9] Brincidofovir wurde ursprünglich für eine Verwendung bei Infektionen mit DNA-Viren entwickelt,[2] jedoch ist es auch wirksam gegen das Ebolavirus.[8] Brincidofovir wurde von der Firma Chimerix entwickelt.
Im Zuge der Ebolafieber-Epidemie 2014 wurde von der Food and Drug Administration ein beschleunigtes Zulassungsverfahren für Brincidofovir eingeleitet und es wurde ab Oktober 2014 in klinischen Phase-II-Studien untersucht.[3][10] Die Weltgesundheitsorganisation schrieb in einer Stellungnahme, dass es im Zuge der Ebolafieber-Epidemie 2014 ethisch akzeptabel sei, präventive oder therapeutische Arzneimittel ohne Nachweis der Wirksamkeit im Menschen bei ebendiesen einzusetzen, wenn in Tierversuchen vielversprechende Ergebnisse gezeigt werden konnten.[11]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b D. F. Florescu, M. A. Keck: Development of CMX001 (Brincidofovir) for the treatment of serious diseases or conditions caused by dsDNA viruses. In: Expert Review of Anti-Infective Therapy. Band 12, Nummer 10, Oktober 2014, S. 1171–1178, doi:10.1586/14787210.2014.948847. PMID 25120093.
- ↑ a b Chimerix Announces Emergency Investigational New Drug Applications for Brincidofovir Authorized by FDA for Patients With Ebola Virus Disease. Archiviert vom am 8. Oktober 2014; abgerufen am 8. Oktober 2014.
- ↑ D. C. Quenelle, B. Lampert, D. J. Collins, T. L. Rice, G. R. Painter, E. R. Kern: Efficacy of CMX001 against herpes simplex virus infections in mice and correlations with drug distribution studies. In: The Journal of Infectious Diseases. Band 202, Nummer 10, November 2010, S. 1492–1499, doi:10.1086/656717. PMID 20923374. PMC 2957530 (freier Volltext).
- ↑ Irma M. Grossi, Scott A. Foster, Melicia R. Gainey, Robert Krile, John A. Dunn, Thomas M. Brundage, Jody M. Khouri: Efficacy of delayed brincidofovir treatment against a lethal rabbitpox virus challenge in New Zealand White rabbits. In: Antiviral Research. 2017, Band 143, S. 278–286 doi:10.1016/j.antiviral.2017.04.002.
- ↑ A. E. Tollefson, J. F. Spencer, B. Ying, R. M. Buller, W. S. Wold, K. Toth: Cidofovir and brincidofovir reduce the pathology caused by systemic infection with human type 5 adenovirus in immunosuppressed Syrian hamsters, while ribavirin is largely ineffective in this model. In: Antiviral Research. Band 112, Dezember 2014, S. 38–46, doi:10.1016/j.antiviral.2014.10.005. PMID 25453340.
- ↑ D. F. Smee, A. Dagley, B. Downs, J. Hagloch, E. B. Tarbet: Enhanced efficacy of cidofovir combined with vaccinia immune globulin in treating progressive cutaneous vaccinia virus infections in immunosuppressed hairless mice. In: Antimicrobial Agents and Chemotherapy. [elektronische Veröffentlichung vor dem Druck] November 2014, doi:10.1128/AAC.04289-14. PMID 25385098.
- ↑ a b David Kroll: Chimerix's Brincidofovir Given To Dallas, Nebraska Ebola Patients. forbes.com, 7. Oktober 2014, abgerufen am 14. Januar 2015.
- ↑ D. F. Florescu, M. A. Keck: Development of CMX001 (Brincidofovir) for the treatment of serious diseases or conditions caused by dsDNA viruses. In: Expert review of anti-infective therapy. Band 12, Nummer 10, Oktober 2014, S. 1171–1178, doi:10.1586/14787210.2014.948847. PMID 25120093.
- ↑ Wall Street Journal: Chimerix to Conduct Ebola Drug Trial: Drug Company Gets FDA Approval to Start Trial Immediately in Infected Patients.
- ↑ WHO - Ethical considerations for use of unregistered interventions for Ebola virus disease. Abgerufen am 8. Oktober 2014.