Hexannitril
(Weitergeleitet von Capronitril)
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
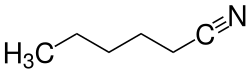
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Hexannitril | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C6H11N | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 97,16 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||||||||
| Dichte |
0,81 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
164 °C[1] | ||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Brechungsindex |
1,406 (20 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Hexannitril ist eine chemische Verbindung aus der Gruppe der Nitrile.
Vorkommen[Bearbeiten | Quelltext bearbeiten]
Hexannitril wurde in Tabakrauch nachgewiesen.[4]
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Hexannitril kann durch Reaktion von 1-Chlorpentan oder 1-Brompentan[5] mit Natriumcyanid gewonnen werden,[6] wobei auch andere Synthesewege bekannt sind.[7]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Hexannitril ist eine farblose Flüssigkeit, die praktisch unlöslich in Wasser ist.[1][2]
Sicherheitshinweise[Bearbeiten | Quelltext bearbeiten]
Die Dämpfe von Hexannitril können mit Luft ein explosionsfähiges Gemisch (Flammpunkt 43 °C) bilden.[1]
Weblinks[Bearbeiten | Quelltext bearbeiten]
- Ole John Nielsen, Cecilie Litske Carstens u. a.: Atmospheric chemistry of hexanenitrile: Kinetics and products of the gas-phase reactions of CH3(CH2)4CN with Cl atoms and OH radicals. In: Chemical Physics Letters. 688, 2017, S. 7–10; doi:10.1016/j.cplett.2017.09.030.
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f g h i j Eintrag zu Hexannitril in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- ↑ a b c d Datenblatt Hexanenitrile, 98% bei Sigma-Aldrich, abgerufen am 1. Januar 2019 (PDF).
- ↑ David R. Lide: CRC Handbook of Chemistry and Physics A Ready-reference Book of Chemical and Physical Data. CRC Press, 1995, ISBN 978-0-8493-0595-5, S. 308 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Alan Rodgman, Thomas A. Perfetti: The Chemical Components of Tobacco and Tobacco Smoke, Second Edition. CRC Press, 2013, ISBN 978-1-4665-1548-2, S. 1886 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Michael B. Smith: Organic Synthesis. Academic Press, 2016, ISBN 978-0-12-800807-2, S. 548 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Robert Smiley, Charles Arnold: Aliphatic Nitriles from Alkyl Chlorides. In: The Journal of Organic Chemistry. 25, 1960, S. 257–258, doi:10.1021/jo01072a600.
- ↑ Alan R. Katritzky, Steven V. Ley, Otto Meth-Cohn, Charles Wayne Rees: Comprehensive Organic Functional Group Transformations: Synthesis: carbon with one heteroatom attached by a single bond. Elsevier, 1995, ISBN 978-0-08-042323-4, S. 1057 (eingeschränkte Vorschau in der Google-Buchsuche).

