Dess-Martin-Periodinan
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Dess-Martin-Periodinan | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C13H13IO8 | |||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 424,14 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
1,36 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Dess-Martin-Periodinan ist eine chemische Verbindung, die in der organischen Synthese zum Oxidieren von primären Alkoholen zu Aldehyden und sekundären Alkoholen zu Ketonen genutzt wird. Es ist nach den amerikanischen Chemikern Daniel Benjamin Dess und James Cullen Martin benannt, über die sie 1983 erstmals berichteten.[5] Gegenüber Oxidationsmitteln auf Chrom- oder DMSO-Basis (Jones- bzw. Swern-Oxidation) hat Dess-Martin-Periodinan verschiedene Vorteile. Dazu gehören neben milderen Bedingungen, geringerer Toxizität, kürzeren Reaktionszeiten und höheren Ausbeuten auch eine einfachere Aufarbeitung nach der Reaktion.
Synthese[Bearbeiten | Quelltext bearbeiten]
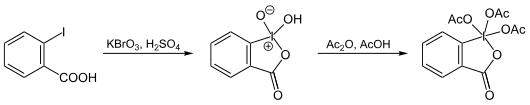
Die Synthese geht von der 2-Iodbenzoesäure aus, welche im ersten Schritt mittels Kaliumbromat zu IBX (1-Hydroxy-1,2-benziodoxol-3(1H)-on-1-oxid) oxidiert wird. Das Zielmolekül ergibt sich im zweiten Schritt durch Acetylierung mit Acetanhydrid und Essigsäure.[6][3]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Die Verbindung ist thermisch instabil. Beim Erhitzen unter Einschluss auf Temperaturen ab 130 °C kann es zur explosionsartigen Zersetzung kommen.[7] Die Verbindung ist nicht schlagempfindlich.[8] In Gegenwart von Wasser oder auch Luftfeuchtigkeit erfolgt die Hydrolyse zu IBX.[3]
Verwendung[Bearbeiten | Quelltext bearbeiten]
Dess-Martin-Periodinan wird bei der Dess-Martin-Oxidation eingesetzt.
Literatur[Bearbeiten | Quelltext bearbeiten]
- Dess, DB. und Martin, JC. (1983): Readily accessible 12-I-5 oxidant for the conversion of primary and secondary alcohols to aldehydes and ketones. In: J. Org. Chem. 48 (22), 4155–4156; doi:10.1021/jo00170a070
- Dess, DB. und Martin, JC. (1991): A useful 12-I-5 triacetoxyperiodinane (the Dess-Martin periodinane) for the selective oxidation of primary or secondary alcohols and a variety of related 12-I-5 species. In: J. Am. Chem. Soc. 113 (19), 7277–7287; doi:10.1021/ja00019a027
- Ireland, RE. und Liu, L. (1993): An improved procedure for the preparation of the Dess-Martin periodinane. In: J. Org. Chem. 58 (10), S. 2899; doi:10.1021/jo00062a040;
- Meyer, SD. und Schreiber, SL. (1994): Acceleration of the Dess-Martin Oxidation by Water. In: J. Org. Chem. 59 (24), 7549–7552; doi:10.1021/jo00103a067
- Boeckman, R. J. In Encyclopedia of Reagents for Organic Synthesis; Paquette, L. A., Ed.; Wiley: Chichester, UK, 1995, Vol. 7, S. 4982–4987. (Review)
- Boeckman, Jr., RK.; Shao, P.; Mullins, JJ.: The Dess-Martin Periodinane: 1,1,1-Triacetoxy-1,1-dihydro-1,2-benziodoxol-3(1H)-one In: Organic Syntheses. 77, 2000, S. 141, doi:10.15227/orgsyn.077.0141; Coll. Vol. 10, 2004, S. 696 (PDF).
Weblinks[Bearbeiten | Quelltext bearbeiten]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d Eintrag zu Dess-Martin Periodinane, >95% bei TCI Europe, abgerufen am 22. Dezember 2023.
- ↑ Eintrag zu Dess-Martin periodinane bei Thermo Fisher Scientific, abgerufen am 13. Oktober 2023.
- ↑ a b c Dess, D.B.; Martin, J.C.: A Useful 12-I-5 Triacetoxyperiodinane (the Dess-Martin Periodinane) for the Selective Oxydation of Primary or Secondary Alcohols and a Variety of Related 12-I-5 Species in J. Am. Chem. Soc. 113 (1991) 7277–72787. doi:10.1021/ja00019a027
- ↑ a b Datenblatt Dess-Martin periodinane, 97% bei Sigma-Aldrich, abgerufen am 2. November 2021 (PDF).
- ↑ A. Speicher, V. Bomm, T. Eicher: Dess-Martin-Periodinan (DMP). In: Journal für Praktische Chemie/Chemiker-Zeitung. Band 338, Nr. 1, 1996, S. 588–590, doi:10.1002/prac.199633801112.
- ↑ D. B. Dess: J. C. Martin: Readily accessible 12-I-5 oxidant for the conversion of primary and secondary alcohols to aldehydes and ketones in J. Org. Chem. 48 (1983) 4155-4156. doi:10.1021/jo00170a070.
- ↑ Plumb, J. B.; Harper, D. J.: Chem. Eng. News 1990, 68 (29), 3.
- ↑ Dallaston, M.A.; Bettencourt, C.J.; Chow, S.; Gebhardt, J.; Spangler, J.; Johnston, Mr.R.; Wall, G.; Brusnahan, J.S.; Williams, C.M.: Ranking Oxidant Sensitiveness: A Guide for Synthetic Utility in Chem. Eur. J. 25 (2019) 9614–9618, doi:10.1002/chem.201902036.

