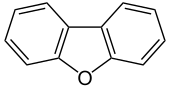
Dibenzofuran
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Dibenzofuran | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C12H8O | ||||||||||||||||||
| Kurzbeschreibung |
farblose, blau fluoreszierende Nadeln[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 168,19 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,3 g·cm−3 (20 °C)[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
285 °C[2] | ||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Dibenzofuran ist eine heterocyclische aromatische organische Verbindung, die aus einem Furanring in der Mitte und zwei daran kondensierten Benzolringen besteht. An jedes der äußeren Kohlenstoffatome ist jeweils ein Wasserstoffatom gebunden. Dibenzofuran ist ein aromatischer Ether.
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Dibenzofuran zeigt besondere Eigenschaften im Hinblick auf die Elektrophile aromatische Substitution. So werden sowohl bei der Friedel-Crafts-Alkylierung, als auch bei der Friedel-Crafts-Acylierung und außerdem bei oxidativen Halogenierungen in 2-Position substituierte Produkte gebildet, bei der Nitrierung hingegen in 3-Position substituierte. Takashi Keumi et al. konnten 1990 zeigen, dass diese Anomalie mit der Konzentration der Nitroniumionen in der Nitrierlösung zusammenhängt, welche wiederum mit der Dielektrizitätskonstante des Lösungsmittels korreliert. Anders formuliert wird mehr 3-nitriertes Produkt gebildet, wenn ein sehr polares Lösungsmittel gewählt wird und bei wenig polaren Lösungsmitteln entsteht auch eine gewisse Menge des 2-nitrierten Produkts. Weiterhin lässt sich die Selektivität der Nitrierung umkehren, wenn diese unter Friedel-Crafts-Bedingungen stattfindet. Das bedeutet, dass statt Salpetersäure ein Alkylnitrat als Nitrierungsreagenz eingesetzt wird und zusätzlich mit Aluminiumtrichlorid oder Titantetrachlorid katalysiert wird. Hierbei können Nitroalkane oder Nitrobenzol als Lösungsmittel dienen. Spezifisch sind all diese elektrophilen aromatischen Substitutionen allerdings nie; es werden immer auch geringe Mengen jeweils aller anderen möglichen Isomere gebildet.[3]
Verwendung[Bearbeiten | Quelltext bearbeiten]
Dibenzofuran ist in einigen Wärmebadmischungen und Kerzenmassen enthalten und wird zur Herstellung von Biphenylen verwendet. Es gibt auch natürliche Derivate wie die Usninsäure.[1]
Dibenzofurane[Bearbeiten | Quelltext bearbeiten]
Unter Dibenzofuranen kann man auch eine ganze Stoffklasse verstehen, in der die Wasserstoffatome durch andere Atome oder Gruppen ersetzt sind. Zum Beispiel sind im 2,3,7,8-Tetrachlordibenzofuran (TCDF) die Wasserstoffatome an den Kohlenstoffatomen 2, 3, 7 und 8 durch Chloratome ersetzt. Polychlorierte Dibenzofurane sind sehr giftige Stoffe mit ähnlichen Eigenschaften wie die Dioxine.
Das Dibenzofuran TCDF (2,3,7,8-Tetrachlordibenzofuran) ist die Dibenzofuran-Entsprechung des Dibenzodioxins und Sevesogifts 2,3,7,8-Tetrachlordibenzodioxin.

Siehe auch[Bearbeiten | Quelltext bearbeiten]
- Furan, die Entsprechung ohne kondensierte Benzolringe.
- Benzofuran, die Entsprechung mit nur einem kondensierten Benzolring.
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d Eintrag zu Dibenzofuran. In: Römpp Online. Georg Thieme Verlag, abgerufen am 4. April 2014.
- ↑ a b c d e Eintrag zu Dibenzofuran in der GESTIS-Stoffdatenbank des IFA, abgerufen am 18. Januar 2020. (JavaScript erforderlich)
- ↑ T. Keumi, N. Tomioka, K. Hamanaka, H. Kakihara, T. Morita, H. Kitajima, M Fukushima: Positional reactivity of dibenzofuran in electrophilic substitutions. In: The Journal of Organic Chemistry. Band 56, Nr. 15, 1991, S. 4671–4677, doi:10.1021/jo00015a020.
