Diskussion:Kritischer Punkt (Thermodynamik)
Einspritzung überkritischer Flüssigkeiten[Quelltext bearbeiten]
Warum wird der Entwurf nicht übernommen? Ich meine es ist wichtig und passt auch zum Artikel. (nicht signierter Beitrag von 84.147.227.59 (Diskussion | Beiträge) 19:45, 10. Mär. 2010 (CET))
Was ist damit gemeint?--178.142.77.73 11:00, 10. Nov. 2020 (CET)
Artikelherkunft[Quelltext bearbeiten]
Dieser Artikel wurde von Kritischer Punkt hierher verschoben. Die vollständige Diskussion und Versionsgeschichte findet sich auf diesem weiter existierenden Artikel, der momentan als Redirect auf diese Seite fungiert. In Kürze wird der Artikel 'ordnungsgemäß', also mit Diskussion und Versionsgeschichte hierher verschoben. Darian 15:34, 13. Okt 2005 (CEST)
Dichte am kritischen Punkt[Quelltext bearbeiten]
Die Dichte am kritischen Punkt muß in der Tabelle zweimal eingetragen werden: Einmal für die Flüssigkeit, einmal für das Gas. Ich habe die beiden Werte einmal für Wasser herausgesucht:
- rho' = 0,32 kg/dm³ (Flüssigkeit)
- rho'' = 312,50 kg/m³ (Gas)
--Markus Schweiß 17:31, 19. Okt 2004 (CEST)
- Muß mich selber korrigieren, selbstverständlich gibt es nur ein spezifisches Volumen am kritischen Punkt. Den Wasserwert werde ich aber noch einpflegen. --Markus Schweiß 17:53, 19. Okt 2004 (CEST)
Sortierkriterium Tabelle Kritische Daten[Quelltext bearbeiten]
Wie soll diese Tabelle sortiert werden.
- Alphabetisch nach Stoffbezeichnung; Elemente und Verbindungen in einer Liste
- Alphabetisch nach Stoffbezeichnung; Getrennt nach Element und Verbindungen (2 Subtabellen/Abschnitte)
- ganz anders
-- Thomas 09:06, 20. Dez 2004 (CET)
- pro 1 --Thomas 09:06, 20. Dez 2004 (CET)
Neues Lemma[Quelltext bearbeiten]
Habe den Artikel unter dem neuen Lemma 'Kritischer Punkt (Thermodynamik)' eingestellt. Inzwischen existieren neben diesem Artikel noch 'Kritischer Punkt (Mathematik)' und 'Kritischer Punkt (Dynamik)', daher erschien mir diese Benennung konsistenter. Um die vielen Linkzusammenhänge nicht zu zerstören, habe ich aber ein Redirect gesetzt. Hoffe, das trifft so auf Zustimmung. Darian 13:57, 13. Okt 2005 (CEST)
- Hallo Darian, im Prinzip finde ich Deine Aktion gut, die Begriffe zu unterscheiden. Bloß bleiben, so wie Du es gemacht hast, die Diskussion und Versionsgeschichte auf Kritischer Punkt zurück und werden nicht mitverschoben zu Kritischer Punkt (Thermodynamik). Besser wäre es gewesen, den Artikel samt Geschichte und Disk. mit der Verschieben-Option zu transferieren. Das geht allerdings nur, wenn Kritischer Punkt (Thermodynamik) nicht existiert, was jetzt nicht mehr der Fall ist. Daher schlage ich einen Schnelllösch-Antrag für letzteres Lemma vor, um es danach richtig verschieben zu können. Abgesehen davon hat Kritischer Punkt (Thermodynamik) eine allgemeinere Bedeutung in der Theorie der kontinuierlichen Phasenübergänge (siehe z.B. engl. WP) und tritt nicht nur bei Flüssigkeiten und Gasen auf. Ich werde mal in den nächsten Tagen versuchen, das reinzubringen, was allerdings nicht so einfach werden dürfte, da der Artikel von Benutzer:Saperaud bereits ziemlich ausführlich (nur leider m.E. zu speziell) ist. Viele Grüße, --Tinz 14:33, 13. Okt 2005 (CEST)
- Hallo Tinz, mir war gar nicht klar, dass es diese Möglichkeit gibt, da habe ich hier wohl eine zu lange Pause gemacht :-) Ich habe versucht, das Problem mit der Versionsgeschichte zu umgehen, indem ich in der Geschichte von Kritischer Punkt (Thermodynamik) einen Kommentar geschrieben habe, dass sich die vollständige Geschichte hier befindet. Die von dir vorgeschlagene Variante ist da natürlich viel besser. Damit keine Missverständnisse auftreten, bis die echte Verschiebung möglich ist, werde ich auch übergangsweise auch einen Verweis auf die Diskussionsseite von Kritischer Punkt (Thermodynamik) stellen. Deinem inhaltlichen Kommentar stimme ich übrigends vollkommen zu, die Theorie der Phasenübergänge umfasst ja noch eine ganze Reihe anderer Phänomene. Gruss, Darian 15:20, 13. Okt 2005 (CEST)
Diagramm[Quelltext bearbeiten]
Das hier abgebildete Phasendiagramm suggeriert das bei Temperaturen über dem kritischen Punkt es durch Druckerhöhung zur Resublimation kommt. Ich bin ja wirklich kein Chemieexperte, aber das halte ich nicht für korrekt. Was sagt ihr dazu?
Wieso nicht? Schau Dir das Diagram mal genau an, besonders ab welchen Drücken das passieren wird. zwischen 1000 und 10000 bar! 1 bar ist etwa der Luftdruck den Du am Meerespiegel spürst. 2.2 bar ist etwa der Druck den Du in einem PKW-Reifen hast. Im Diagramm reden wir aber von Drücken die tausend bis zehntausendmal höher sind als das was Du im Autoreifen hast!
Gruss Thomas, dipl. chem. ing.
Links[Quelltext bearbeiten]
Ich habe "Kritische Temperatur", "Kritischer Druck" und "Kritische Dichte" verlinkt; es gibt dazu aber anscheinend noch keine eigenen Artikel; bei einem werde ich sogar auf diese seite geleitet!
könnte da mal jemand etwas darüber schreiben?
--CHK 01:13, 1. Jan 2006 (CET)
Phasendiagramm[Quelltext bearbeiten]
Hallo, wäre es möglich den kritischen Punkt in dem gegebenen Phasendiagramm farblich hervorzuheben. Am besten mit Rot. Das würde mE einem Interessierten zeigen wo genau alles abläuft bzw. von was der Artikel handelt. 141.51.213.64 19:39, 19. Feb 2006 (CET) Gruß Brösel
- Also ich muss ehrlich sagen: Dass man von den sechs im Diagramm genannten Begriffen denjenigen, der mit dem Lemma übereinstimmt, heraussuchen muss, ist mir die Mühe nicht wert, das Diagramm herunterzuladen, zu ändern, usw. -- Pemu 00:45, 22. Feb 2006 (CET)
kritischer punkt[Quelltext bearbeiten]
die werte für kritischen druck und kritische temperatur von wasser sind in beiden tabellen völlig unterschiedlic. da stimmt doch was nicht.
- Das ist einmal Kelvin, einmal °C. Der Druck ist einmal in atm und einmal in MPa. Daher die Verwirrung. Ich werde jetzt die kleinere Tabelle in die größere einarbeiten. Ich hoffe, dass noch jemand die kritischen Dichten raussucht. -- 217.232.39.42 23:48, 21. Sep 2006 (CEST)
Lemma...[Quelltext bearbeiten]
Als kritischen Punkt bezeichnet man eigentlich all das, was früher "Phasenübergang zweiter Ordnung" hieß. (Quellen: Peskin Schroeder, Zee, sowie vermutlich jedes moderne Buch über statistische Mechanik oder Quantenfeldtheorie) Hier ist nur ein bestimmter kritischer Punkt (es ist tatsächlich ein Phasenübergang 2. Ordnung) beschrieben. Das ist eine unzulässige Einengung des Begriffs. -- 84.61.143.213 17:09, 21. Jul 2006 (CEST)
Weblink[Quelltext bearbeiten]
Der Link http://www.nottingham.ac.uk/supercritical/scintro.html funktioniert nicht.
You don't have permission to access /supercritical/scintro.html on this server.
Form der Dampfdruckkurve[Quelltext bearbeiten]
Die Dampfdruck-Kurve in der Graphik ist falsch. Es handelt sich um eine Exponentialfunktion zwischen dem Tripelpunkt und dem kritischen Punkt. --W.Arlt, Prof. in Erlangen, 84.149.150.172
- Kommentar aus dem Artikel gelöscht (Kommentare gehören ohnehin in die Diskussion und nicht in den Artikel).
- Die Dampfdruckkurve ist näherungsweise eine Exponentialfunktion. Da die Grafik im Artikel eine logarithmische Druck-Achse verwendet, ergibt sich darin näherungsweise eine Gerade. Die Grafik ist also in Ordnung.-- kwr 10:30, 21. Nov. 2007 (CET)
Stoffe im überkritischen Bereich bei Zimmertemperatur und Atmosphärendruck[Quelltext bearbeiten]
Gibt es Substanzen, die bei Zimmertemperatur und Atmosphärendruck im überkritischen Zustand vorliegen? Wenn nein, warum nicht? Welche Substanz wird beim niedrigsten Druck überkritisch? Ja, eine solch wundervolle Substanz gibt es tatsächlich! Die Luft, welche wir täglich atmen, befindet sich im überkritischen Zustand! Maßgebend ist für die Beurteilung in allererster Linie immer die kritische Temperatur. Wenn diese überschritten wird, insbesonders hoch überschritten wird, hat man die Substanz im gasförmigen Zustand (das ist dann garantiert überkritisch) vor sich "liegen". Egal, wie hoch der Druck ist! Die Behauptung, man könne nicht zwischen Gas und Flüssigkeit unterscheiden, gilt nur am kritischen Punkt selbst. Darüber hat man immer den "reinen" Gaszustand und je weiter man sich von der kritischen Temperatur entfernt, desto idealer wird der Gaszustand. Dann "gehorcht" das Gas wieder der einfachen Gaszustandsgleichung (pV=RT). (nicht signierter Beitrag von 87.161.66.97 (Diskussion) 16:09, 14. Jun. 2013 (CEST))
kommt in der Natur vor[Quelltext bearbeiten]
Da das Lemma überkritisch hierhin verweist, wäre es vielleicht eine Erwähnung wert, wenn Material im überkritischen Zustand auf der Erde natürlich vorkommt. Im Artikel http://www.fr-online.de/in_und_ausland/wissen_und_bildung/aktuell/1398490_Forscher-finden-heissestes-Wasser-der-Erde.html hört es sich für mich so an (es geht um Wasser an vulkanisch aktiven Stellen auf dem Meeresgrund). Die Terminologie passt aber nicht hundertprozentig klar, weswegen ich es nicht in den Artikel genommen habe. Gibt es hier Leute mit wissenschaftlich soliden Informationen darüber? --91.8.213.141 13:11, 9. Aug. 2008 (CEST)
Gutes Bild[Quelltext bearbeiten]
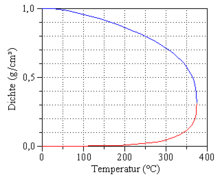
Im Artikel Dampfdruck ist ein schönes Bild, das hier vielleicht auch gut hinpassen würde.--Christoph Scholz 16:01, 24. Sep. 2007 (CEST)
- Es fehlt die Angabe des Drucks bei dem die angegebenen Temperaturen und Dichten gelten! --Juliabackhausen 10:17, 15. Mai 2010 (CEST)
Tabelle Kritischer Zustandsgrößen[Quelltext bearbeiten]
Diese Tabelle war im Artikel:
| Stoff | kritische Temperatur in K |
kritischer Druck in MPa |
kritische Dichte in kg/m3 |
|---|---|---|---|
| Wasserstoff | 33,3 | 1,297 | 310 |
| Helium | 5,3 | 0,229 | 690 |
| Stickstoff | 126,1 | 3,394 | 311 |
| Sauerstoff | 155,4 | 5,035 | 410 |
| Fluor | 144 | 5,96 | 630 |
| Neon | 44 | 2,72 | 484 |
| Chlor | 417 | 7,69 | 573 |
| Argon | 151 | 4,85 | 531 |
| Krypton | 209,4 | 5,88 | 908 |
| Xenon | 289,7 | 6,31 | 1105 |
| Kohlenstoffdioxid | 304,2 | 7,375 | 468 |
| Kohlenmonoxid | 132 | 3,64 | 301 |
| Luft | 133 | 3,95 | 328 |
| Ammoniak | 405,6 | 11,595 | 235 |
| Wasser | 647,1 | 22,12 | 317 |
| Methan | 190,2 | 4,619 | 163 |
| Ethan | 305 | 4,87 | 207 |
| Propan | 370 | 4,24 | 220 |
| Butan | 425 | 3,78 | 228 |
| Ethin (Azetylen) | 308 | 6,4 | 231 |
| Ethen (Äthylen) | 282 | 5,04 | 215 |
| Ethanol | 489 | 6,59 | 276 |
| Benzol | 565 | 5,07 | 302 |
| Diethylether | 467 | 3,75 | 263 |
| Quecksilber | 1750 | 172 | ? |
| Die Angaben verschiedener Gruppen über die hier dargestellten Messergebnisse unterliegen teilweise recht großen Schwankungen. | |||
- "WARNUNG: die werte von Wasserstoff und Helium sind in dieser tabelle 10-fach groesser als die werte auf Wasserstoff und Helium ! " --Benutzer:Siwardio
- Das bezieht sich offenbar auf die kritische Dichte, beim Wasserstoff ist die laut (exzellentem) Artikel und anderen Seiten im Netz 0,03136 g/cm3 was mit Umrechnungsfaktor 1000 31 kg/m^3 ist und nicht 310. Helium analog. Stickstoff dagegen scheint zu stimmen - hat jemand ein Chemiebuch und kann die Daten nachschlagen? --Tinz 00:23, 1. Jul. 2008 (CEST)
- Ich finde es schade, dass ihr die Tabelle rausgeschmissen habt - die war schön kompakt! Jetzt muss man sich die Daten zusammensuchen - das ist mühsam!
- die Tabelle steht ja hier weiter oben, und auch warum sie draussen ist. Besser mühsam als falsch, würde ich sagen. --Tinz 19:17, 14. Mär. 2009 (CET)
- Wer kann die Tabelle überprüfen? Dann kann sie wieder in den Artikel rein. Das wäre schön. --Juliabackhausen 10:17, 15. Mai 2010 (CEST)
- die Tabelle steht ja hier weiter oben, und auch warum sie draussen ist. Besser mühsam als falsch, würde ich sagen. --Tinz 19:17, 14. Mär. 2009 (CET)
- Ich finde es schade, dass ihr die Tabelle rausgeschmissen habt - die war schön kompakt! Jetzt muss man sich die Daten zusammensuchen - das ist mühsam!
- Das bezieht sich offenbar auf die kritische Dichte, beim Wasserstoff ist die laut (exzellentem) Artikel und anderen Seiten im Netz 0,03136 g/cm3 was mit Umrechnungsfaktor 1000 31 kg/m^3 ist und nicht 310. Helium analog. Stickstoff dagegen scheint zu stimmen - hat jemand ein Chemiebuch und kann die Daten nachschlagen? --Tinz 00:23, 1. Jul. 2008 (CEST)
Dazu nehme man den VDI Wärmeatlas. --178.142.77.73 11:41, 10. Nov. 2020 (CET)
Benzinmotor-Verbrauch unter 3 Liter[Quelltext bearbeiten]
Was ist damit gemeint? 3 liter auf hundert Kilometer? Für ein auto welcher masse? (nicht signierter Beitrag von 91.97.5.198 (Diskussion) 21:02, 9. Jan. 2011 (CET))
- Vermutlich kommt es bei einer Autobahnfahrt in den USA nicht direkt auf die Masse, sondern eher auf andere Dinge an. Finde diesen Satz aber auch nicht gelungen. Werde ihn ändern.--79.250.4.236 22:48, 26. Jul. 2015 (CEST)
Entdeckung[Quelltext bearbeiten]
Bitte auflösen: Hier wird geschrieben "Diese Annahme wurde um 1860 von dem irischen Physiker und Chemiker Thomas Andrews widerlegt. Anhand von Untersuchungen mit CO2 konnte er zeigen, dass es einen Punkt gibt, ab dem der Unterschied zwischen Gas und Flüssigkeit nicht mehr existent ist", und im Artikel "Überkritisches_Wasser" steht "Das Phänomen der überkritischen Fluide ist seit 1822 bekannt. Damals entdeckte Baron Charles Cagniard de la Tour die Existenz einer kritischen Temperatur, oberhalb der die Phasengrenze flüssig/gasförmig einer in einem Druckgefäß eingeschlossenen Flüssigkeit verschwindet. " -- Wer kann das zumindest kommentieren? (nicht signierter Beitrag von 198.182.37.200 (Diskussion) 14:01, 9. Feb. 2012 (CET))
Achtung Editwar:[Quelltext bearbeiten]
http://de.wikipedia.org/w/index.php?title=Kritischer_Punkt_%28Thermodynamik%29&diff=124734166&oldid=124733950 (nicht signierter Beitrag von 77.24.141.8 (Diskussion) 21:18, 22. Nov. 2013 (CET))
Vielen Dank für den Hinweis. Ohne Deinen hämischen Beitrag hätten wir sicher gar nicht bemerkt, dass Du einen Krieg von Zaum brechen möchtest. Schade, dass es Dir nur um den Krieg, nicht um die Verbesserung der Wikipedia geht. --Pyrometer (Diskussion) 12:50, 24. Nov. 2013 (CET)
- Geschätzte Damen und Herren mit den Skimasken!
- Im Artikel Kohlenwasserstoff-Taupunkt ist eine entsprechende Erklärung weiterhin zu finden. Dort gehört sie hin.
- Die Weiterleitungsbegriffe Krikondentherm/Cridondentherm wurden entfernt. Wegen Relevanz und Begriffsetablierung.
- Völlig zu Recht. Es handelt sich um sehr spezielle Fachbegriffe der englischen Sprache, deren deutsche Entsprechung nur in einer äußerst schmalen Sparte der Petrochemie eine Bedeutung hat.
- Enzyklopädische Arbeit besteht nicht darin, den Lesern an unpassenden Stellen (dort) irrelevantes Wissen aufzudrängen.
- --Pyrometer (Diskussion) 12:50, 24. Nov. 2013
Links zu Praktikums-Experimenten[Quelltext bearbeiten]
Frage: Sollten unter Weblinks Verweise zu Praktikums-Anleitungen wie die beiden folgenden in den Artikel einzufügt werden, um dem Leser Hinweise zu geben, wie denn nun in der Praxis kritischen Punkte gemessen werden? Was spricht dagegen? Hier die Links: tu-ilmenau Physikpraktikum/Anleitungen/W7 Reales Gas und kritischer Punkt und henschke-geraetebau Kritischer-Punkt ArchibaldWagner (Diskussion) 21:42, 2. Dez. 2019 (CET)
Kritisches Volumen[Quelltext bearbeiten]
Es sollte das kritische Volumen in die Tabellen aufgenommen werden. Am besten auch das Molgewicht. --178.142.77.73 11:02, 10. Nov. 2020 (CET)
:Kritischer Punkt (Thermodynamik)[Quelltext bearbeiten]
Zitat
Bei technischen Gasen, die in normalen Gasflaschen bei Umgebungstemperatur transportiert und gelagert werden, können nur Gase mit hoher kritischer Temperatur verflüssigt werden, wie beispielsweise Propan oder Butan. Die kritische Temperatur des Gases muss nämlich so hoch sein, dass sie bei Lagerung, Transport und Einsatz sicher nie überschritten wird.
Dieser Abschnitt ist nutzlos und irreführend natürlich darf in den Gasflaschen die kritische Temperatur auch überschritten werden. Sonst dürften co2 Kartusche (beispielsweise wassermax) nicht über 32 Grad gelagert werden . Da steht außerdem irgendwas...mit verflüssigt werden. ? Werden die Gase in den Gasflaschen verflüssigt? Irgendwie ist das alles sinnlos. Wenn kein einwand besteht möchte icj Abschnitt komplett löschen
--Erol2k (Diskussion) 21:36, 7. Jul. 2023 (CEST)
- Um das Gas dennoch verflüssigt zu speichern,
- (:befüllen: statt speicherm wäre wohl angebracht)
- muss es zusätzlich soweit abgekühlt werden, dass die Isotherme der niedrigeren Temperatur wieder ins Nassdampfgebiet (also unterhalb des kritischen Punktes) eintritt. Wird die kritische Temperatur gerade so unterschritten, so muss auch noch der Druck den kritischen Druck überschreiten, um die Verflüssigung einzuleiten. Ist der kritische Druck jedoch für die Anwendung bzw. Lagerung zu hoch, dann muss eine tiefere Temperatur gewählt werden, um mit entsprechend niedrigerem Druck die Verflüssigung zu erreichen.
- Zitat=
- befüllen.
- Ist der kritische Druck jedoch für die Anwendung bzw. Lagerung zu hoch, dann muss eine tiefere Temperatur gewählt werden, um mit entsprechend niedrigerem Druck die Verflüssigung zu erreichen.
- Zitat ende
- Ich verstehe den Zusammenhang nicht warum muss eine tiefere Temperatur gewählt werden zum lagern? --Erol2k (Diskussion) 21:44, 7. Jul. 2023 (CEST)