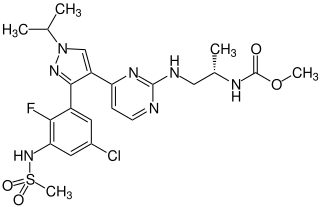
Encorafenib
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Freiname | Encorafenib | |||||||||||||||
| Andere Namen |
Methyl-[(2S)-1-{[4-(3-{5-chlor-2-fluor-3-[(methylsulfonyl)amino]phenyl}-1-isopropyl-1H-pyrazol-4-yl)-2-pyrimidinyl]amino}-2-propanyl]carbamat (IUPAC)
| |||||||||||||||
| Summenformel | C22H27ClFN7O4S | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| ATC-Code | ||||||||||||||||
| Wirkstoffklasse |
Serin/Threonin-Kinase-Inhibitor | |||||||||||||||
| Wirkmechanismus |
Hemmung der BRAF-Kinase | |||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 540,01 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Encorafenib (ehemals LGX818) ist ein Arzneistoff aus der Gruppe der Proteinkinaseinhibitoren, resp. der MAP-Kinase-Inhibitoren, der die Funktion des Proteins BRAF hemmt.[2] Encorafenib – in Kombination mit Binimetinib – wird angewendet zur Behandlung von Erwachsenen mit nicht-resezierbarem (d. h. nicht operablem) oder metastasiertem Melanom mit einer BRAF-V600-Mutation.[3][4][5]
Encorafenib weist in biochemischen Untersuchungen eine hohe Verweildauer (Dissoziationshalbwertszeit) von mehr als 30 Stunden am mutierten BRAFV600E-Protein auf – im Gegensatz zu 2 Stunden bei Dabrafenib und 0,5 Stunden bei Vemurafenib.[6][7]
Im Juni 2018 hat die US-amerikanische Zulassungsbehörde (FDA) Encorafenib in Kombination mit Binimetinib zugelassen.[8] Der Ausschuss für Humanarzneimittel (CHMP) empfahl im Juli 2018 die Zulassung für die Mitgliedsländer der EU.[9] Die Europäische Kommission folgte dieser positiven Empfehlung und erteilte die EU-Zulassung im September 2018.[10][11]
Klinische Angaben[Bearbeiten | Quelltext bearbeiten]
Anwendungsgebiete[Bearbeiten | Quelltext bearbeiten]
Encorafenib in Kombination mit Binimetinib ist angezeigt zur Behandlung von erwachsenen Patienten mit nicht-resezierbarem oder metastasiertem Melanom mit einer BRAF-V600-Mutation.[11]
Art und Dauer der Anwendung[Bearbeiten | Quelltext bearbeiten]
Braftovi ist zum Einnehmen, die empfohlene Dosis beträgt täglich 450 mg Encorafenib in Kombination mit Binimetinib. Mahlzeiten beeinträchtigen die Wirkung nicht. Die Behandlung sollte weitergeführt werden, bis der Patient keinen Nutzen mehr davon hat, oder eine inakzeptable Toxizität auftritt.[11]
Besondere Patientengruppen[Bearbeiten | Quelltext bearbeiten]
Vor der Einnahme von Encorafenib in Kombination mit Binimetinib muss bei den Patienten eine BRAF-V600-Mutation mittels eines validen Tests nachgewiesen worden sein. Die Wirksamkeit und Sicherheit von Encorafenib wurde nur für Patienten mit Tumoren, die eine BRAF-V600E- und V600K-Mutation exprimieren, belegt. Encorafenib darf nicht bei Patienten mit einem malignen Melanom vom BRAF-Wildtyp angewendet werden.[11]
BRAF-Mutationstest[Bearbeiten | Quelltext bearbeiten]
Der BRAF-Mutationstest (BRAF-Assay) kann Tumore mit der BRAF-Mutation identifizieren und soll ihr mögliches Ansprechen auf BRAF-Inhibitoren wie z. B. Encorafenib einzuschätzen helfen. Die Testung kann mittels DNA-basierten Methoden oder mittels Immunhistochemie für die häufigste Mutation (BRAF-V600E) erfolgen.[12][13]
Die Rolle des BRAF-Gens[Bearbeiten | Quelltext bearbeiten]
Das BRAF-Gen gehört zu einer Klasse von Genen, die als Onkogene bezeichnet werden. Es liefert die Anleitung zur Herstellung eines Proteins, das dabei unterstützt, chemische Signale von außerhalb der Zelle in den Zellkern zu übertragen. Dieses Protein ist Teil eines Signalwegs, der als RAS/MAPK-Signalweg bekannt ist und mehrere wichtige Zellfunktionen steuert. Konkret regelt der RAS/MAPK-Weg das Wachstum und die Teilung (Proliferation) von Zellen, den Prozess der Zellreifung zur Ausübung bestimmter Funktionen (Differenzierung), die Zellbewegung (Migration) und die Selbstzerstörung von Zellen (Apoptose). Chemische Signale über diesen Weg sind für die normale Entwicklung vor der Geburt und die nachgeburtliche Zellteilung und Differenzierung unerlässlich. Nach Mutation haben Onkogene das Potenzial, normale Zellen in krebsartige umzuwandeln. Während der Krebsbehandlung können gezielte Therapien das Auftreten der Mutation verhindern und so das Wachstum des Tumors verlangsamen.
Unerwünschte Wirkungen[Bearbeiten | Quelltext bearbeiten]
Die folgenden Ereignisse wurden unter der Kombinationstherapie mit Encorafenib und Binimetinib in der Standarddosierung sehr häufig (>= 1/10) beobachtet: Anämie, periphere Neuropathie, Schwindelgefühl, Kopfschmerzen, Sehstörungen, Ablösung retinales Pigmentepithel, Blutungen, Hypertonie, Abdominalschmerz, Diarrhoe, Erbrechen, Übelkeit, Obstipation, Hyperkeratose, Hautausschlag, trockene Haut, Pruritus, Alopezie, Arthralgie, Muskelerkrankungen / Myalgie, Rückenschmerzen, Schmerzen in den Extremitäten, Pyrexie, peripheres Ödem, Fatigue, Anstieg Kreatinkinase im Blut, Anstieg Transaminasen, Anstieg Gamma-Glutamyl-Transferase.[14]
Pharmakologische Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Wirkungsmechanismus[Bearbeiten | Quelltext bearbeiten]
Encorafenib ist ein hoch-selektiver, ATP-kompetitiver, niedermolekularer Inhibitor der RAF-Kinase. Die halb-maximale inhibitorische Konzentration (IC50) von Encorafenib gegen BRAFV600E-, BRAF- und CRAF-Enzyme wurde mit 0,35 nM, 0,47 nM bzw. 0,30 nM bestimmt. Die Dissoziations-Halbwertszeit von Encorafenib betrug > 30 Stunden und führte zu einer verlängerten pERK-Hemmung. Encorafenib unterdrückt den RAF/MEK/ERK-Signalweg in Tumorzellen, die verschiedene Mutationsformen der BRAF-Kinase (V600E, D und K) exprimieren. Encorafenib hemmt in vitro und in vivo spezifisch das Wachstum von Melanomzellen mit BRAFV600E, D- und K Mutation. Encorafenib unterdrückt nicht den RAF/MEK/ERK-Signalweg in Zellen, die den BRAF-Wildtyp exprimieren.[11]
Encorafenib und der MEK-Inhibitor Binimetinib hemmen beide den MAP-Kinase-Signalweg, was zu einer höheren Antitumor-Aktivität führt. Darüber hinaus verhindert die Kombination Encorafenib plus Binimetinib in vivo bei humanen Melanom-Xenografts mit BRAFV600E-Mutation die Entwicklung einer Resistenz. Binimetinib erhöht zusammen mit Encorafenib gegenüber der BRAF-Inhibitor-Monotherapie die Wirksamkeit bei adäquater Verträglichkeit.[2][15] In der Zulassungsstudie COLUMBUS erwies sich Braftovi in Kombination mit Mektovi als adäquat verträglich und zeigte gegenüber der BRAF-Inhibitor-Monotherapie in einigen Aspekten ein günstigeres Nebenwirkungsprofil mit einer vergleichbaren Rate an höhergradigen unerwünschten Ereignissen – trotz der höheren Dosierung und längeren Therapiedauer im Vergleich zur Monotherapie.[16][17]
Aufnahme und Verteilung im Körper[Bearbeiten | Quelltext bearbeiten]
Encorafenib weist in biochemischen Untersuchungen eine hohe Verweildauer (Dissoziationshalbwertszeit) von mehr als 30 Stunden am mutierten BRAFV600E-Protein auf – im Gegensatz zu 2 Stunden bei Dabrafenib und 0,5 Stunden bei Vemurafenib, beide ebenfalls MAP-Kinase-Inhibitoren.[6][7]
Die Resorption von Encorafenib erfolgt rasch mit einer medianen Tmax von 1,5–2 Stunden. Die Einnahme von Encorafenib ist mit und ohne Nahrung möglich. Die Ausscheidung erfolgt zu gleichen Teilen über die Fäzes und den Urin; die terminale Halbwertszeit beträgt 6,32 Stunden.[6]
Studien[Bearbeiten | Quelltext bearbeiten]
COLUMBUS (Zulassungsstudie): Die Sicherheit und Wirksamkeit von Encorafenib in Kombination mit Binimetinib wurde in einer 2-teiligen, randomisierten, wirkstoff-kontrollierten, offenen, multi-zentrischen Phase-III-Studie (CMEK162B2301) in Patienten mit nicht-resezierbarem oder metastasiertem Melanom mit BRAF-V600E- oder -K-Mutation untersucht, die mittels BRAF-Assay festgestellt wurden. Die Patienten hatten ein histologisch bestätigtes kutanes Melanom oder ein histologisch bestätigtes Melanom mit unbekanntem Primärtumor; Patienten mit Aderhaut- oder Schleimhautmelanom waren von der Studienteilnahme ausgeschlossen worden. Eine vorherige adjuvante Therapie sowie eine vorherige Immuntherapie-Linie zur Behandlung der nicht-resezierbaren, lokal fortgeschrittenen oder metastasierten Erkrankung waren zulässig. Eine vorherige Behandlung mit BRAF-/MEK-Inhibitoren war nicht zulässig.[18]
Für die Zulassung war insbesondere der Teil 1 der COLUMBUS-Studie relevant. In diesem Studienteil wurden 577 Patienten im Verhältnis 1:1:1 in die folgenden 3 Behandlungsarme randomisiert: Encorafenib 450 mg einmal täglich plus Binimetinib 45 mg zweimal täglich; Encorafenib 300 mg einmal täglich; Vemurafenib 960 mg zweimal täglich. Die Phase-III-Studie zeigte – laut unabhängigem zentralem Review, dass die Kombination von Encorafenib 450 mg einmal täglich und Binimetinib 45 mg zweimal täglich das progressionsfreie Überleben (PFS) im Vergleich zur Vemurafenib-Monotherapie 960 mg zweimal täglich signifikant verbessert (Median 14,9 versus 7,3 Monate; Hazard Ratio [HR]=0,54; 95 % Konfidenzintervall [KI]: 0,41–0,71; p < 0,0001). Das PFS war der primäre Endpunkt der Studie.[16]
Im September 2018 in The Lancet Oncology publizierte Daten des zweiten Teils zeigen, dass die Behandlung mit Encorafenib + Binimetinib – als sekundärer Endpunkt der Studie – ein medianes Gesamtüberleben (OS) von 33,6 Monaten erzielte, im Vergleich zu 16,9 Monaten für Patienten, die mit Vemurafenib als Monotherapie behandelt wurden (HR=0,61; 95 % KI: 0,47–0,79; nominelles p < 0,0001).[17]
Handelsnamen[Bearbeiten | Quelltext bearbeiten]
Der Handelsname des Monopräparat von Encorafenib ist Braftovi vom Hersteller Pierre Fabre.
Literatur[Bearbeiten | Quelltext bearbeiten]
- Ernst Mutschler et al.: Mutschler – Arzneimittelwirkungen Lehrbuch der Pharmakologie und Toxikologie. 10. Auflage. Wissenschaftl. Verlagsgesellschaft, Stuttgart 2012, ISBN 978-3-8047-2898-1.
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b Datenblatt (S)-Methyl (1-((4-(3-(5-chloro-2-fluoro-3-(methylsulfonamido)phenyl)-1-isopropyl-1H-pyrazol-4-yl)pyrimidin-2-yl)amino)propan-2-yl)carbamate, 98% (PDF) bei BLD Pharmatech, Katalognummer: BD334277, abgerufen am 14. April 2024.
- ↑ a b Koelblinger P et al.: Development of encorafenib for BRAF-mutated advanced melanoma. In: Current Opinion in Oncology. Band 30, Nr. 2, März 2018, S. 125–133, doi:10.1097/CCO.0000000000000426, PMID 29356698, PMC 5815646 (freier Volltext).
- ↑ Community register of medicinal products for human use - Braftovi European Commission, abgerufen am 21. Oktober 2018.
- ↑ Community register of medicinal products for human use - Mektovi European Commission, abgerufen am 21. Oktober 2018.
- ↑ Braftovi (encorafenib) – An overview of Braftovi and why it is authorised in the EU, EPAR der EMA, abgerufen am 21. Oktober 2018.
- ↑ a b c Fachinformation Braftovi, abgerufen am 21. Oktober 2018.
- ↑ a b Delord J-P et al.: Phase I Dose-Escalation and -Expansion Study of the BRAF Inhibitor Encorafenib (LGX818) in Metastatic BRAF-Mutant Melanoma. In: Clinical Cancer Research. Band 23, Nr. 19, September 2017, S. 5339–5348, doi:10.1158/1078-0432.CCR-16-2923, PMID 28611198.
- ↑ Center for Drug Evaluation and Research: Approved Drugs - FDA approves encorafenib and binimetinib in combination for unresectable or metastatic melanoma with BRAF mutations. In: www.fda.gov. Abgerufen am 28. Juni 2018.
- ↑ Braftovi - encorafenib Summary of opinion (initial authorisation), PM EMA vom 26. Juli 2018, abgerufen am 21. Oktober 2018.
- ↑ EMA: Braftovi, EPAR der EMA (englisch), abgerufen am 21. Oktober 2018
- ↑ a b c d e EMA: Zusammenfassung des Arzneimittels, abgerufen am 21. Oktober 2018.
- ↑ D. Capper, A. S. Berghoff, M. Magerle, A. Ilhan, A. Wöhrer, M. Hackl, J. Pichler, S. Pusch, J. Meyer, A. Habel, P. Petzelbauer, P. Birner, A. von Deimling, M. Preusser: Immunohistochemical testing of BRAF V600E status in 1,120 tumor tissue samples of patients with brain metastases. In: Acta Neuropathol. 123(2), Feb 2012, S. 223–233. doi:10.1007/s00401-011-0887-y.
- ↑ D. Capper, M. Preusser, A. Habel, F. Sahm, U. Ackermann, G. Schindler, S. Pusch, G. Mechtersheimer, H. Zentgraf, A. von Deimling: Assessment of BRAF V600E mutation status by immunohistochemistry with a mutation-specific monoclonal antibody. In: Acta Neuropathol. 122(1), Jul 2011, S. 11–19. doi:10.1007/s00401-011-0841-z.
- ↑ Braftovi® + Mektovi® Deutschland ( des vom 21. Oktober 2018 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis., Kurzfachinfos auf oncosite.de, abgerufen am 21. Oktober 2018.
- ↑ Fachinformation Mektovi, abgerufen am 21. Oktober 2018.
- ↑ a b Dummer R et al.: Encorafenib plus binimetinib versus vemurafenib or encorafenib in patients with BRAF-mutant melanoma (COLUMBUS): a multicentre, open-label, randomised phase 3 trial. In: The Lancet Oncology. Band 19, Nr. 5, Mai 2018, S. 603–615, doi:10.1016/S1470-2045(18)30142-6, PMID 29573941.
- ↑ a b Dummer R et al.: Overall survival in patients with BRAF-mutant melanoma receiving encorafenib plus binimetinib versus vemurafenib or encorafenib (COLUMBUS): a multicentre, open-label, randomised, phase 3 trial. In: The Lancet Oncology. Band 19, Nr. 10, Oktober 2018, S. 1315-27, doi:10.1016/S1470-2045(18)30497-2, PMID 30219628.
- ↑ Study Comparing Combination of LGX818 Plus MEK162 Versus Vemurafenib and LGX818 Monotherapy in BRAF Mutant Melanoma (COLUMBUS), ClinicalTrials.gov, abgerufen am 21. Oktober 2018.
Weblinks[Bearbeiten | Quelltext bearbeiten]
- Krebsinformationsdienst (KID). Hautkrebs: Basaliome, Plattenepithelkarzinome, maligne Melanome. Februar 2013.