Ephaptische Übertragung
Ephaptische Übertragung (altgriechisch ἔφαψις éphapsis, deutsch ‚berührend, liebkosend‘) ist eine Form der Kommunikation im Nervensystem und unterscheidet sich von direkten Kommunikationssystemen wie den elektrischen und chemischen Synapsen. Der Begriff kann sich auf die Übertragung von Signalen zwischen zwei aneinander liegenden (sich berührenden) Nervenfasern durch den Austausch von Ionen beziehen, oder es kann die Signalübertragung durch lokale elektrische Felder bezeichnen.[1] In beiden Fällen kann ephaptische Übertragung die Synchronisation und den zeitlichen Ablauf des Aktionspotentials der beteiligten Neuronen beeinflussen. Es wird vermutet, dass die Myelinisierung von Nervenzellen ephaptische Interaktionen hemmt.[2]
Geschichte und Etymologie[Bearbeiten | Quelltext bearbeiten]
Die Idee, elektrische Aktivität von Nervengewebe könne die Aktivität von umliegendem Nervengewebe beeinflussen, lässt sich bereits im späten 19. Jahrhundert nachweisen. Frühe Experimente wie die von Boys-Reymond[3] zeigten, dass die Erregung eines primären Nervs zur Erregung eines benachbarten sekundären Nervs führen könne (genannt secondary excitation ‚sekundäre Erregung‘). Dieser Effekt wurde jedoch nicht weiter quantitativ untersucht, bis 1940 in Experimenten von Katz und Schmitt elektrische Interaktionen zwischen zwei benachbarten Nerven von Gliedmaßen der gemeinen Strandkrabbe untersucht wurden.[4] Ihre Arbeit zeigte, dass das Fortschreiten des Aktionspotentials des aktiven Axons zu Veränderungen im Erregungszustand des inaktiven Axons führte. Diese Veränderungen wurden den lokalen Strömen, die das Aktionspotential bilden, zugeschrieben.
Zum Beispiel führte eine Depolarisation (Erregung) des aktiven Nervs zu einer Hyperpolarisation (Hemmung) des anliegenden ruhenden Nervs. Ähnlich führten die Ströme, die den aktiven Nerv repolarisierten, zu einer leichten Depolarisation des anliegenden ruhenden Nervs. Katz und Schmitt beobachteten außerdem, dass die Stimulation beider Nerven zu Interferenzen führen konnte. Gleichzeitiges Auftreten eines Aktionspotentials führte zu Interferenzen und einer verringerten Leitgeschwindigkeit. Hingegen führte eine leicht zeitlich verschobene Stimulation zu einer Synchronisation beider Impulse.
1941 erforschte Angélique Arvanitaki[5] dasselbe Gebiet und schlug den Begriff Ephapse vor, um dieses Phänomen zu beschreiben und es von der synaptischen Übertragung zu unterscheiden. Mit der Zeit wurde der Begriff ephaptische Übertragung nicht nur im Fall einer elektrischen Interaktion zwischen benachbarten Elementen gebraucht, sondern auch allgemeiner, um Effekte zu beschreiben, die durch irgendeine Änderung des elektrischen Feldes entlang der Zellmembran entstanden.[6]
Wirkungsweise und Effekte[Bearbeiten | Quelltext bearbeiten]
Erregung und Hemmung[Bearbeiten | Quelltext bearbeiten]
Die frühe Arbeit von Katz und Schmitt zeigte, dass ephaptische Übertragung zwischen zwei benachbarten Nerven nicht ausreichte, um am ruhenden Nerv ein Aktionspotential auszulösen. Die maximale Depolarisation, die unter Idealbedingungen beobachtet werden konnte, betrug etwa 20 % des Schwellenpotentials.[4] Jedoch können die Bedingungen so beeinflusst werden, dass sich das Aktionspotential eines Neurons zu einem benachbarten Neuron ausbreiten kann. In einer Studie wurde dies mit zwei experimentellen Bedingungen geschafft: erhöhte Kalziumkonzentration, die das Schwellenpotential absenkte, oder durch Untertauchen der Axone in Mineralöl, was zu einem erhöhten Widerstand führte. Obwohl diese Veränderungen nicht normale Bedingungen widerspiegeln, zeigen sie doch die Mechanismen hinter der emphatischen Erregung auf.[7]
Es wurde ebenfalls herausgefunden, dass ephaptische Übertragung eine wichtige Rolle in der Hemmung benachbarter Neuronen spielt. Abhängig von dem Ort und der Identität der Neuronen wurden verschiedene Wirkungsweisen gefunden, die einer ephaptischen Hemmung zugrunde liegen. In einer Studie wechselwirkten neu erregte Neuronen mit bereits vorhandenen Strömen, senkten dadurch das extrazelluläre Potential und depolarisierten das Neuron im Vergleich zu seinem näheren Umfeld. Somit wurde die Ausbreitung des Aktionspotentials unterbunden.[8]
Synchronisation und Timing[Bearbeiten | Quelltext bearbeiten]
Studien zur ephaptischen Übertragung legten den Fokus auch auf seine Rolle bei der Synchronisation und beim Timing von Aktionspotentialen in Neuronen. Im einfacheren Fall von benachbarten Fasern, die beide gleichzeitig stimuliert werden, wird der Impuls verlangsamt, weil beide Fasern auf den Austausch von Ionen mit der Gewebsflüssigkeit beschränkt sind. Dies führt zu einer Erhöhung des Widerstands der Nerven. Zeitlich leicht verschobene Impulse (mit einem Unterschied der Leitgeschwindigkeit von weniger als 10 %) können Ionen konstruktiv austauschen. Das Aktionspotential breitet sich leicht phasenverschoben mit derselben Geschwindigkeit aus.
Neuere Forschung konzentrierte sich jedoch auf den allgemeineren Fall von elektrischen Feldern, die eine Vielzahl an Neuronen beeinflussen. Es wurde beobachtet, dass lokale Feldpotentiale in kortikalen Neuronen neuronale Aktivität synchronisieren können.[9] Obwohl die Wirkungsweise unbekannt ist, wird vermutet, dass Neuronen an die Frequenzen des lokalen Feldpotentials gekoppelt sind. Diese Kopplung könnte Neuronen effektiv in Zeitspannen mit erhöhter Erregbarkeit (oder Hemmung) synchronisieren und zu bestimmten Mustern des Aktionspotential-Timings führen. Dieser Effekt wurde in verschiedenen Fällen demonstriert und modelliert.[10][11]
Eine Hypothese oder Erklärung des Mechanismus ist der „Einbahnstraßen“-, „Master-Slave“- oder „gleichlaufende Synchronisation“-Effekt als mathematische und fundamentale Eigenschaft nichtlinearer dynamischer Systeme (Oszillatoren wie Neuronen), die sich unter bestimmten Bedingungen synchronisieren. Ein solches Phänomen wurde seit 2010 in Simulationen und Modellarbeiten von Dalibor Hrg als Möglichkeit zwischen zwei Neuronen nach dem Hindmarsh–Rose-Modell vorgeschlagen und vorhergesagt.[12] Es wurde ebenfalls aufgezeigt, dass sich solche gleichlaufenden Synchronisationen oder ein „Copy/Paste“-Transfer neuraler Dynamiken von primären zu sekundären Neuronen auf unterschiedliche Arten zeigen können. Deshalb ist das Phänomen nicht nur von fundamentalem Interesse, sondern findet auch von der Behandlung von Epilepsie bis zu neuartigen Lernmethoden Anwendung. Synchronisierung von Neuronen ist grundsätzlich ein unerwünschtes Verhalten, da das Gehirn keine Information enthalten würde, wenn alle Neuronen synchron wären. Daher besteht die Hypothese, dass sich die Neurobiologie evolutionär angepasst hat, um ein synchrones Erregen der Neuronen in großer Zahl zu verhindern, und es stattdessen in wenigen Spezialfällen nutzt.
-
Schematische Darstellung der bioelektromagnetischen Feldverteilung im Neocortex und Gliocortex
-
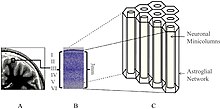
Schematische Darstellung von Neuronen (N) und Astrozyten (A) in der zweiten und dritten Schicht des menschlichen Neocortex
Da Modelle der Gehirnfunktion ausschließlich unter Berücksichtigung von neuronalen und Gap-Junction-Verbindungen die Komplexität des Gehirns nicht zu erklären vermögen, werden ephaptische Verbindungen vermehrt miteinbezogen, um die Isopotentialität kortikaler Astrozyten, die für das bioelektromagnetische Übersprechen zwischen Neuronen und Astrozyten im Neocortex verantwortlich ist, zu erklären zu versuchen.[13]
Beispiele[Bearbeiten | Quelltext bearbeiten]
Herzmuskelfasern[Bearbeiten | Quelltext bearbeiten]

Das Erregungsleitungssystem des Herzens wurde bereits gründlich erforscht. Jedoch stellt neue Forschung einige bisher akzeptierte Modelle in Frage. Die Rolle ephaptischer Übertragung in Herzmuskelzellen wird immer mehr ersichtlich. Ein Autor geht sogar so weit, zu sagen „While previously viewed as a possible alternative to electrotonic coupling, ephaptic coupling has since come to be viewed as operating in tandem with gap junctions, helping sustain conduction when gap junctional coupling is compromised.“ (deutsch: „Während sie früher als mögliche Alternative zur elektrotonischen Kopplung angesehen wurde, ist die ephaptische Übertragung heute als im Tandem mit Gap Junctions funktionierend zu sehen; sie hilft dabei, die Leitfähigkeit aufrecht zu erhalten, wenn die Übertragung mittels Gap Junctions kompromittiert ist.“)[14]
Ephaptische Wechselwirkungen zwischen Herzmuskelfaserzellen helfen, eine Lücke zu füllen, für die die elektrischen Synapsen alleine nicht ausreichen würden. In letzter Zeit gibt es außerdem einige mathematische Modelle, die ephaptische Übertragungen in Vorhersagen zur elektrischen Leitfähigkeit im Herzen mit einbeziehen.[15] Experimentelle Arbeiten legen nahe, dass Nanobereiche mit einer großen Anzahl an Natriumkanälen an Orten, wo sich Herzmuskelzellen nahe kommen, funktionale Einheiten zur ephaptischen Übertragung darstellen können. Selektive Störungen dieser Nanobereiche resultierten in einer Verlangsamung der arrhythmogenen Leitung, was eine wichtige Rolle der ephaptischen Übertragung nahelegt.[16] Mögliche ephaptische Verbindungen werden nun auch bei Herzmedikamenten in Betracht gezogen.[17][18]
Epilepsie und Anfälle[Bearbeiten | Quelltext bearbeiten]
Epileptische Anfälle geschehen bei Synchronizität elektrischer Wellen im Gehirn. Mit dem Wissen um die Rolle der ephaptischen Übertragung bei der Synchronhaltung von elektrischen Signalen macht es Sinn, bei dieser Symptomatik eine ephaptische Wirkungsweise näher in Betracht zu ziehen. Eine Studie legt nahe, dass Zellen der Gehirnrinde wegen der engen Anordnung der Axone, die die Interaktionen ihrer elektrischen Felder ermöglicht, ein idealer Beobachtungsort für ephaptische Übertragung seien. Es wurden Änderungen des Platzes zwischen den Zellen getestet, was lokale elektrische Felder beeinflusst. Dabei wurde herausgefunden, dass eine epileptische Synchronisation unabhängig von einer Manipulation der chemischen Synapsen verhindert wurde, in dem einfach der Zellzwischenraum vergrößert wurde.[19] Später wurde ein Modell erstellt, um diese Phänomen vorauszusagen. Dieses zeigte Szenarien mit einem größeren intrazellulären Raum, der eine epileptische Synchronisation im Gehirn deutlich unterband.[20]
Olfaktorischer Kortex[Bearbeiten | Quelltext bearbeiten]
Neuronen im olfaktorischen Kortex sind unmyelinisiert und dicht angeordnet, weshalb die schwachen Effekte der ephaptischen Übertragung hier leichter beobachtet werden können. Mehrere Studien haben aufgezeigt, wie die Hemmung zwischen den Neuronen des olfaktorischen Kortex die Signalantwort auf Gerüche fein abstimmen. Es wurde aufgezeigt, dass diese Hemmungen alleine durch Änderungen der elektrischen Potentiale hervorgerufen werden.[8] Mit der Ergänzung der Riechbahnnervenmodelle um die ephaptische Übertragung wird das Modell der „dedicated-line“, bei dem jeder Geruchsrezeptor seinen Reiz an genau ein Neuron weitergibt, weiter untermauert. Die Hemmung durch ephaptische Übertragung würde die Integration von Signalen erklären, die zu einer nuancierten Wahrnehmung von Gerüchen führt.[21]
Synapsen[Bearbeiten | Quelltext bearbeiten]
Synapsen werden typischerweise gebildet, wenn sich zwei Neuronen sehr nahe kommen. Deshalb kann ephaptische Übertragung über den synaptischen Spalt auftreten. Bekannte Beispiele sind Mauthner-Zellen von Fischen,[22] das Ganglion ciliare von Küken,[23] Korbzellensynapsen des Kleinhirns bei Säugetieren[24] und die sich entwickelnden Heldschen Endkelche bei Säugetieren.[25]
Mathematische Modelle[Bearbeiten | Quelltext bearbeiten]
Aufgrund der sehr kleinen Felder, die von Neuronen produziert werden, werden häufig mathematische Modelle eingesetzt, um verschiedene Manipulationen zu testen. Die Kabelgleichung ist eine der wichtigsten Gleichungen in der Neurowissenschaft.[26] Sie berechnet mit Hilfe von Kapazität und Widerstand als Variablen elektrische Ströme, die von Neuronen produziert werden, und war die Grundlage für viele Vorhersagen zur ephaptischen Übertragung in Neuronen. Jedoch haben viele Autoren an ausgefeilteren Modellen gearbeitet, die die Umgebung des Nervensystems genauer widerspiegeln sollen. Zum Beispiel wurden von vielen Autoren Modelle für Herzgewebe vorgeschlagen, die zusätzliche Variablen beinhalten, um der einzigartigen Struktur und Geometrie der Herzzellen,[15] verschiedenen Größenordnungen[27] oder der dreidimensionalen Elektrodiffusion[28] gerecht zu werden.
Tiermodelle[Bearbeiten | Quelltext bearbeiten]
Kalmar-Riesenaxone[Bearbeiten | Quelltext bearbeiten]
1978 wurden grundlegende Untersuchungen an Kalmar-Riesenaxonen durchgeführt, um Beweise für ephaptische Ereignisse zu finden. Es wurde aufgezeigt, dass das Aktionspotential eines Axons zu einem benachbarten Axon weitergeleitet werden kann. Die Übertragungsrate variierte von Veränderungen unter dem Schwellwert bis zur Initiierung eines Aktionspotential bei benachbarten Zellen. Jedoch wurde in allen Fällen ersichtlich, dass es Implikationen von ephaptischer Übertragung gibt, die von physiologischer Wichtigkeit sind.[7]
Rückenmark und Medulla oblongata von Ratten[Bearbeiten | Quelltext bearbeiten]
Eine Studie untersuchte die Wirkung ephaptischer Übertragung, in dem Neurotransmitter-Antagonisten zum Blockieren von chemischen Synapsen sowie Gap-Junction-Blocker zum Blockieren von elektrischen Synapsen verwendet wurden. Dabei wurde herausgefunden, dass rhythmische elektrische Entladungen, die mit fetalen Neuronen in Rückenmark und Medulla oblongata von Ratten im Zusammenhang stehen, immer noch vorhanden waren. Dies legt nahe, dass Verbindungen zwischen Neuronen immer noch existierten und Signale ohne traditionelle Synapsen weiterleiten konnten. Diese Ergebnisse unterstützen ein Modell, nach dem die ephaptische Übertragung zusammen mit kanonischen Synapsen Signale im neuronalen Netzwerk überträgt.[29]
Purkinjezellen im Kleinhirn von Ratten[Bearbeiten | Quelltext bearbeiten]
Einer der wenigen bekannten Fälle eines funktionalen Systems, in welchem ephaptische Übertragung für ein beobachtbares physiologisches Ereignis verantwortlich ist, sind die Purkinjezellen im Kleinhirn von Ratten.[24] In dieser Studie wurde aufgezeigt, dass die Korbzellen, welche einige Bereiche von Purkinjezellen umschließen, eine hemmende Wirkung auf die Purkinjezellen haben können. Die Erregung dieser Korbzellen, die schneller geschieht als in den Purkinjezellen, erzeugt einen Strom durch die Purkinjezellen und generiert ein passives hyperpolarisierendes Potential, das die Aktivität der Purkinjezelle hemmt. Obwohl die genaue funktionale Rolle dieser Hemmung immer noch unklar ist, könnte sie einen synchronisierenden Effekt auf die Purkinjezellen haben, da die ephaptische Wirkung die Erregungszeit verringert.
Ein ähnlicher Effekt wurde in Mauthner-Zellen von echten Knochenfischen beobachtet.[30]
Skepsis[Bearbeiten | Quelltext bearbeiten]
Obwohl die Idee nicht-synaptischer Interaktionen zwischen Neuronen bereits seit dem 19. Jahrhundert besteht, war dazu historisch viel Skeptizismus im Gebiet der Neurowissenschaft vorhanden. Viele Leute glaubten, dass die elektrischen Mikrofelder so klein seien, dass sie vernachlässigt werden könnten.[21] Während viele Unterstützer der Theorie zur ephaptischen Übertragung deren Existenz zu beweisen versuchten, äußern einige Gegner in diesem Bereich Vorsicht. Zum Beispiel publizierte Bradley J. Roth 2014 eine Überprüfung, in der er sich skeptisch gegenüber der Idee der ephaptischen Übertragung äußert und aussagt “The agreement between their simulations and Poelzing’s data is impressive, but I will need a more definitive experimental confirmation before I can embrace the ephaptic hypothesis.” (deutsch: „Die Übereinstimmung zwischen ihren Simulationen und Poelzings Daten ist beeindruckend, aber wir benötigen eine definitivere experimentelle Bestätigung, bevor ich mich mit der ephaptischen Hypothese anfreunden kann.“)[31] Er begründet seine Vorsicht damit, dass zwischen der Ladungsübertragung in der Gap Junction und der ephaptischen Übertragung genauer unterschieden werden müsse. Viele im Feld Tätige sind noch nicht ganz von überzeugt, dass eindeutige Beweise für die ephaptische Übertragung vorliegen.
2018 wurde ein scheinbar endgültiges Experiment veröffentlicht.[32] Der Prozess der langsamen Wellenausbreitung im Gehirn mit einer Geschwindigkeit von etwa 0,1 Metern pro Sekunde wurde in vivo beobachtet. Eine langsame Wellenausbreitung konnte ebenfalls beobachtet werden, indem zwei Elektroden in zwei Enden eines Stücks Gehirn einer frisch getöteten Maus gesteckt wurden. Das Gewebe wurde dann zwischen den beiden Elektroden zerschnitten. Dabei wurde jegliche mögliche Verbindung durch Neuronen und Gap Junctions zwischen den Elektroden durchtrennt. Die langsame Welle breitete sich weiter aus und konnte nur durch eine Trennung der beiden Hälften von etwa 400 Mikrometern gestoppt werden. Unter Annahme der Reproduzierbarkeit dieses Experiments sollten nun auch Skeptiker der ephaptischen Übertragung von der Existenz dieses Phänomens überzeugt sein. Weitere Untersuchungen sollten sich deshalb auf die Wirkungsweise und die Rolle der ephaptischen Übertragung konzentrieren und nicht auf ihre Existenz.
Siehe auch[Bearbeiten | Quelltext bearbeiten]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Dorian Aur, Mandar S. Jog: Neuroelectrodynamics - Understanding the Brain Language. In: Neuroelectrodynamics (= Biomedical and Health Research. Band 47). IOS Press, 2010, ISBN 978-1-60750-473-3, S. 1–235, doi:10.3233/978-1-60750-473-3-i (englisch).
- ↑ Daniel K. Hartline: What is myelin? In: Neuron Glia Biology. Band 4, Nr. 2, Mai 2008, ISSN 1740-925X, S. 153–163, doi:10.1017/S1740925X09990263 (englisch, cambridge.org [abgerufen am 17. Februar 2023]).
- ↑ Wilhelm Biedermann: Electro-physiology v.2. Macmillan, 1898, S. 270– (englisch, google.com).
- ↑ a b Bernhard Katz, Otto H. Schmitt: Electric interaction between two adjacent nerve fibres. In: The Journal of Physiology. 97. Jahrgang, Nr. 4, 14. Februar 1940, S. 471–88, doi:10.1113/jphysiol.1940.sp003823, PMID 16995178, PMC 1393925 (freier Volltext) – (englisch).
- ↑ Angélique Arvanitaki: Effects Evoked in an Axon by the Activity of a Contiguous One. In: Journal of Neurophysiology. 5. Jahrgang, Nr. 2, 1. März 1942, ISSN 0022-3077, S. 89–108, doi:10.1152/jn.1942.5.2.89 (englisch).
- ↑ J. G. Jefferys: Nonsynaptic modulation of neuronal activity in the brain: electric currents and extracellular ions. In: Physiological Reviews. 75. Jahrgang, Nr. 4, 1. Oktober 1995, S. 689–723, doi:10.1152/physrev.1995.75.4.689, PMID 7480159 (englisch).
- ↑ a b F. Ramón, J. W. Moore: Ephaptic transmission in squid giant axons. In: American Journal of Physiology. 234. Jahrgang, Nr. 5, 1. Mai 1978, S. C162–9, doi:10.1152/ajpcell.1978.234.5.C162, PMID 206154 (englisch).
- ↑ a b Wynand Van der Goes van Naters: Inhibition among olfactory receptor neurons. In: Frontiers in Human Neuroscience. 7. Jahrgang, 23. Oktober 2013, S. 690, doi:10.3389/fnhum.2013.00690, PMID 24167484, PMC 3805947 (freier Volltext) – (englisch).
- ↑ Costas A Anastassiou, Rodrigo Perin, Henry Markram, Christof Koch: Ephaptic coupling of cortical neurons. In: Nature Neuroscience. 14. Jahrgang, Nr. 2, 16. Januar 2011, S. 217–23, doi:10.1038/nn.2727, PMID 21240273 (englisch, ucl.ac.uk [PDF]).
- ↑ Thomas Radman, Yuzhuo Su, Je Hi An, Lucas C. Parra, Marom Bikson: Spike Timing Amplifies the Effect of Electric Fields on Neurons: Implications for Endogenous Field Effects. In: Journal of Neuroscience. 27. Jahrgang, Nr. 11, 14. März 2007, S. 3030–6, doi:10.1523/JNEUROSCI.0095-07.2007, PMID 17360926, PMC 6672570 (freier Volltext) – (englisch).
- ↑ Costas A. Anastassiou, Sean M. Montgomery, Mauricio Barahona, György Buzsáki, Christof Koch: The Effect of Spatially Inhomogeneous Extracellular Electric Fields on Neurons. In: Journal of Neuroscience. 30. Jahrgang, Nr. 5, 3. Februar 2010, S. 1925–36, doi:10.1523/JNEUROSCI.3635-09.2010, PMID 20130201, PMC 6633973 (freier Volltext) – (englisch).
- ↑ Dalibor Hrg: Synchronization of two Hindmarsh-Rose neurons with unidirectional coupling. In: Neural Networks. 40. Jahrgang, April 2013, S. 73–9, doi:10.1016/j.neunet.2012.12.010, PMID 23454921 (englisch).
- ↑ Marcos Martinez-Banaclocha: Astroglial Isopotentiality and Calcium-Associated Biomagnetic Field Effects on Cortical Neuronal Coupling. In: Cells. 9. Jahrgang, Nr. 2, 13. Februar 2020, S. 439, doi:10.3390/cells9020439 (englisch).
- ↑ Rengasayee Veeraraghavan, Robert G. Gourdie, Steven Poelzing: Mechanisms of cardiac conduction: a history of revisions. In: American Journal of Physiology-Heart and Circulatory Physiology. 306. Jahrgang, Nr. 5, März 2014, S. H619–27, doi:10.1152/ajpheart.00760.2013, PMID 24414064, PMC 3949060 (freier Volltext) – (englisch).
- ↑ a b Joyce Lin, James P. Keener: Modeling electrical activity of myocardial cells incorporating the effects of ephaptic coupling. In: Proceedings of the National Academy of Sciences of the United States of America. 107. Jahrgang, Nr. 49, 15. November 2010, S. 20935–40, doi:10.1073/pnas.1010154107, PMID 21078961, PMC 3000303 (freier Volltext), bibcode:2010PNAS..10720935L (englisch).
- ↑ Rengasayee Veeraraghavan, Gregory S Hoeker, Anita Alvarez-Laviada, Daniel Hoagland, Xiaoping Wan, D Ryan King, Jose Sanchez-Alonso, Chunling Chen, Jane Jourdan, Lori L Isom, Isabelle Deschenes, James W Smyth, Julia Gorelik, Steven Poelzing, Robert G Gourdie: The adhesion function of the sodium channel beta subunit (β1) contributes to cardiac action potential propagation. In: eLife. 7. Jahrgang, 14. August 2018, doi:10.7554/eLife.37610, PMID 30106376, PMC 6122953 (freier Volltext) – (englisch).
- ↑ Ena Ivanovic, Jan P. Kucera: Tortuous Cardiac Intercalated Discs Modulate Ephaptic Coupling. In: Cells. 11. Jahrgang, Nr. 21, 2. November 2022, S. 3477, doi:10.3390/cells11213477 (englisch).
- ↑ Daniel T. Hoagland, Webster Santons, Steven Poelzing, Robert, G. Gourdie: The role of the gap junction perinexus in cardiac conduction: Potential as a novel anti-arrhythmic drug target. In: Progress in Biophysics and Molecular Biology. 144. Jahrgang, Juli 2019, S. 41–50, doi:10.1016/j.pbiomolbio.2018.08.003 (englisch).
- ↑ Dr. F. Edward Dudek, Thomas Yasumura, John E. Rash: 'Non-synaptic' mechanisms in seizures and epileptogenesis. In: Cell Biology International. 22. Jahrgang, Nr. 11–12, 2. Januar 2013, S. 793–805, doi:10.1006/cbir.1999.0397, PMID 10873292 (englisch).
- ↑ R. Greg Stacey, Lennart Hilbert, Thomas Quail: Computational study of synchrony in fields and microclusters of ephaptically coupled neurons. In: Journal of Neurophysiology. 113. Jahrgang, Nr. 9, 15. Mai 2015, S. 3229–41, doi:10.1152/jn.00546.2014, PMID 25673735, PMC 4440237 (freier Volltext) – (englisch).
- ↑ a b Hemant Bokil, Nora Laaris, Karen Blinder, Mathew Ennis, Asaf Keller: Ephaptic Interactions in the Mammalian Olfactory System. In: Journal of Neuroscience. 21. Jahrgang, Nr. 20, 15. Oktober 2001, S. RC173, doi:10.1523/JNEUROSCI.21-20-j0004.2001, PMID 11588203, PMC 6763860 (freier Volltext) – (englisch).
- ↑ Donald S. Faber, Paul G. Funch: Differential properties of orthodromic and antidromic impulse propagation across the Mauthner cell initial segment. In: Brain Research. 190. Jahrgang, Nr. 1, 10. Januar 1980, S. 255–260, doi:10.1016/0006-8993(80)91176-2, PMID 7378738 (englisch, elsevier.com).
- ↑ A. R. Martin, G. Pilar: An analysis of electrical coupling at synapses in the avian ciliary ganglion. In: The Journal of Physiology. 171. Jahrgang, Nr. 3, 1. Juli 1964, S. 454–475, doi:10.1113/jphysiol.1964.sp007390, PMID 14193934, PMC 1368844 (freier Volltext) – (englisch).
- ↑ a b Antoin Blot, Boris Barbour: Ultra-rapid axon-axon ephaptic inhibition of cerebellar Purkinje cells by the pinceau. In: Nature Neuroscience. 17. Jahrgang, Nr. 2, 12. Januar 2014, ISSN 1097-6256, S. 289–295, doi:10.1038/nn.3624, PMID 24413696 (englisch, nature.com).
- ↑ Martijn C. Sierksma, J. Gerard G. Borst: Using ephaptic coupling to estimate the synaptic cleft resistivity of the calyx of Held synapse. In: Hugues Berry (Hrsg.): PLOS Computational Biology. 17. Jahrgang, Nr. 10, 26. Oktober 2021, ISSN 1553-7358, S. e1009527, doi:10.1371/journal.pcbi.1009527, PMID 34699519, PMC 8570497 (freier Volltext) – (englisch).
- ↑ Claude Bédard, Alain Destexhe: Generalized cable theory for neurons in complex and heterogeneous media. In: Physical Review E. 88. Jahrgang, Nr. 2, 13. August 2013, S. 022709, doi:10.1103/PhysRevE.88.022709, PMID 24032866, arxiv:1304.5674, bibcode:2013PhRvE..88b2709B (englisch).
- ↑ Paul E. Hand, Boyce E. Griffith: Adaptive multiscale model for simulating cardiac conduction. In: Proceedings of the National Academy of Sciences of the United States of America. 107. Jahrgang, Nr. 33, 29. August 2010, S. 14603–8, doi:10.1073/pnas.1008443107, PMID 20671202, PMC 2930419 (freier Volltext), bibcode:2010PNAS..10714603H (englisch).
- ↑ Yoichiro Mori, Glenn I. Fishman, Charles S. Peskin: Ephaptic conduction in a cardiac strand model with 3D electrodiffusion. In: Proceedings of the National Academy of Sciences of the United States of America. 105. Jahrgang, Nr. 17, 29. April 2008, S. 6463–8, doi:10.1073/pnas.0801089105, PMID 18434544, PMC 2359793 (freier Volltext), bibcode:2008PNAS..105.6463M (englisch).
- ↑ Jun Ren, Yoko Momose-Sato, Katsushige Sato, and John Greer: Rhythmic neuronal discharge in the medulla and spinal cord of fetal rats in the absence of synaptic transmission. In: Journal of Neurophysiology. 95. Jahrgang, Nr. 1, 1. Januar 2006, S. 527–34, doi:10.1152/jn.00735.2005, PMID 16148265 (englisch).
- ↑ Donald S. Faber, Henri Korn: Electrical field effects: their relevance in central neural networks. In: Physiological Reviews. 69. Jahrgang, Nr. 3, 3. Juli 1989, S. 821–63, doi:10.1152/physrev.1989.69.3.821, PMID 2546168 (englisch).
- ↑ Bradley J. Roth: Does Ephaptic Coupling Contribute to Propagation in Cardiac Tissue? In: Biophysical Journal. 106. Jahrgang, Nr. 4, 18. Februar 2014, S. 774–5, doi:10.1016/j.bpj.2014.01.011, PMID 24559978, PMC 3944891 (freier Volltext), bibcode:2014BpJ...106..774R (englisch).
- ↑ Chia‐Chu Chiang, Rajat S. Shivacharan, Xile Wei, Luis E. Gonzalez‐Reyes, Dominique M. Durand: Slow periodic activity in the longitudinal hippocampal slice can self‐propagate non‐synaptically by a mechanism consistent with ephaptic coupling. In: The Journal of Physiology. Band 597, Nr. 1, Januar 2019, ISSN 0022-3751, S. 249–269, doi:10.1113/JP276904, PMID 30295923, PMC 6312416 (freier Volltext) – (wiley.com [abgerufen am 4. Oktober 2023]).