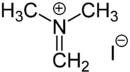
Eschenmosersalz
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Eschenmosersalz | ||||||||||||||||||
| Andere Namen |
N,N-Dimethylmethaniminiumiodid (IUPAC) | ||||||||||||||||||
| Summenformel | C3H8IN | ||||||||||||||||||
| Kurzbeschreibung |
hellgelber Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 185,01 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
Zersetzung in Wasser[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Das Eschenmosersalz ist ein organisches Salz. Es besteht aus einem N,N-Dimethylmethyliden-Kation meist mit einem Iodidion als Gegenion. Auch andere Gegenionen wie Chlorid- oder Nitrationen werden häufig eingesetzt. Das Salz ist benannt nach seinem Entwickler, dem Schweizer Chemiker Albert Eschenmoser.
Das Eschenmosersalz wird zur Dimethylaminomethylierung verwendet, es kann mit ihm also eine Dimethylaminomethyl-Funktion eingeführt werden. Hierzu wird das Salz mit einem Nukleophil umgesetzt. Dieses greift hierzu am Kohlenstoffatom der Doppelbindung an.
Darstellung[Bearbeiten | Quelltext bearbeiten]
Es existieren mehrere Wege zur Synthese von Eschenmosersalz. Von diesen basieren viele auf der Umsetzung von N,N,N',N'-Tetramethylmethandiamin mit iodhaltigen Elektrophilen wie Diiodmethan[3] oder Trimethylsilyliodid.[4] Ein neuerer Ansatz geht vom Hydroiodid des Dimethylamins und Formaldehyd aus.[5]
Siehe auch[Bearbeiten | Quelltext bearbeiten]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c Datenblatt Dimethylmethylenammoniumiodid bei Alfa Aesar, abgerufen am 14. April 2010 (Seite nicht mehr abrufbar).
- ↑ a b Datenblatt N,N-Dimethylmethyleneiminium iodide bei Sigma-Aldrich, abgerufen am 12. Oktober 2016 (PDF).
- ↑ G. R. Clark, G. L. Shaw, P. W. J. Surman, M. J. Taylor, D. Steele: Preparation, Structure and Vibrational Spectrum of the Dimethylmethyleniminium Ion, including the Role of Cationic Polymers in its Formation. In: Journal of the Chemical Society, Faraday Transactions. Band 90, Nr. 20, 1994, S. 3139–3144, doi:10.1039/FT9949003139.
- ↑ T. A. Bryson, G. H. Bonitz, C. J. Reichel, R. E. Dardis: Preformed Mannich Salts: A Facile Preparation of Dimethyl(methylene)ammonium Iodide. In: Journal of Organic Chemistry. Band 45, Nr. 3, 1980, S. 524–525, doi:10.1021/jo01291a032.
- ↑ Tehrani, K. Abbaspour; De Kimpe, N.: Science of Synthesis. Band 27, 2004, Product class 8: iminium salts, S. 313–348.
