Ethylmagnesiumchlorid
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
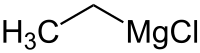
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Ethylmagnesiumchlorid | |||||||||||||||
| Andere Namen |
Chlorethylmagnesium | |||||||||||||||
| Summenformel | C2H5MgCl | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 88,82 g·mol−1 | |||||||||||||||
| Dichte |
0,978 g·cm−3 (25 °C) (Lösung)[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Ethylmagnesiumchlorid ist eine chemische Verbindung aus der Gruppe der Grignard-Verbindungen, welche zu den metallorganischen Verbindungen gehören.
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Ethylmagnesiumchlorid kann durch Reaktion von Ethylchlorid mit Magnesium gewonnen werden.[2]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Ethylmagnesiumchlorid wird kommerziell als farblose bis bräunliche Lösung in Diethylether oder Tetrahydrofuran in den Handel gebracht.[1][3]
Die Verbindung reagiert mit Wasser.[4]
Verwendung[Bearbeiten | Quelltext bearbeiten]
Ethylmagnesiumchlorid kann zur Herstellung anderer chemischer Verbindungen (zum Beispiel n-Propylbenzol, Tetraethylblei[5] und Alkylzinnverbindungen[6]) verwendet werden.[7]
Sicherheitshinweise[Bearbeiten | Quelltext bearbeiten]
Da die Zersetzungswärme von Grignard-Reagenzien mit Wasser groß ist und die Lösungsmittel, in dem sie gelöst werden, leicht flüchtig und brennbar werden, müssen sie mit äußerster Vorsicht behandelt werden.[8]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d Datenblatt Ethylmagnesium chloride solution, 2.0 M in diethyl ether bei Sigma-Aldrich, abgerufen am 15. April 2018 (PDF).
- ↑ R. L. Madan: Chemistry for Degree Students (B.Sc. 1St Yr.). S. Chand, 2010, ISBN 978-81-219-3230-1, S. 586 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Datenblatt Ethylmagnesium chloride, 25% (2.8M) in THF, packaged under Argon in resealable septum cap bottles bei Alfa Aesar, abgerufen am 15. April 2018 (Seite nicht mehr abrufbar).
- ↑ G.C. Gerrans, P. Hartmann-Petersen, Rasmus Hartmann-Petersen: Sasol Encyclopaedia of Science and Technology. New Africa Books, 2004, ISBN 978-1-86928-384-1, S. 108 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Richard Rennie, Jonathan Law: A Dictionary of Chemistry. Oxford University Press, 2016, ISBN 0-19-105943-9 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ A. Townshend, D.T. Burns, Ryszard Lobinski, E.J. Newman, G. Guilbault, Z. Marczenko, H. Onishi: Dictionary of Analytical Reagents. CRC Press, 1993, ISBN 978-0-412-35150-1, S. 1174 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ De Gruyter: Organische Chemie. [Hauptbd.] Walter de Gruyter, 1980, ISBN 978-3-11-082970-9, S. 608 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Robert A. Lewis: Hawley's Condensed Chemical Dictionary. John Wiley & Sons, 2016, ISBN 978-1-119-19372-2, S. 686 (eingeschränkte Vorschau in der Google-Buchsuche).




