Flufenaminsäure
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Flufenaminsäure | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel |
| |||||||||||||||||||||
| Kurzbeschreibung |
Feststoff[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | ||||||||||||||||||||||
| Dichte |
1,47 g·cm−3(Flufenaminsäure)[2] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Dampfdruck |
0,0038 Torr (100,5 °C, Flufenaminsäure)[4] | |||||||||||||||||||||
| Löslichkeit |
0,0265 g·l−1 (37 °C, in Wasser, Flufenaminsäure)[5] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Flufenaminsäure ist ein nichtsteroidales Antirheumatikum und Nichtopioid-Analgetikum aus der Gruppe der Anthranilsäure-Derivate. Es ist in Salben enthalten und kommt bei Gelenkentzündungen und Muskelzerrungen zur Anwendung. Das Arzneimittel hemmt die Cyclooxygenase sowie die Hyaluronidase. Via NFkB wird auch die Expression von COX-II gedrosselt. Es konnte gezeigt werden, dass Flufenaminsäure unselektiv Kationenkanäle hemmt. Die mittlere Eliminationshalbwertszeit beträgt 9h, der extrarenale Eliminationsanteil ist hoch.
Geschichte[Bearbeiten | Quelltext bearbeiten]
In den 1950er Jahren begann die Firma Parke Davis (USA) unter der Leitung von Andrew C. Bratton Jr. mit der Suche nach einem neuen antiphlogistischen Wirkstoff. Die Synthese erfolgte unter Leitung von Eldon M. Jones (1914–1996). Als Entdecker der Flufenaminsäure gilt allerdings Robert A. Scherrer. 1961 meldete Parke Davis Flufenaminsäure erstmals zum Patent in Frankreich an.[8]
Darstellung und Gewinnung[Bearbeiten | Quelltext bearbeiten]
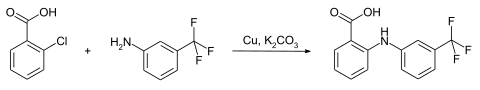
Die Synthese von Flufenaminsäure erfolgt durch die Umsetzung in eine Ullmann-Goldberg-Reaktion von 2-Chlorbenzoesäure mit 3-Trifluormethylanilin in Gegenwart von Kupfer und einer Base.[9][10]
Statt von der 2-Chlorbenzoesäure kann auch vom Brom-[11] bzw. Iodderivat[12] ausgegangen werden.
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Flufenaminsäure zeigt eine ausgeprägte Tendenz zur Ausbildung polymorpher Formen.[1] Mittels thermoanalytischer und IR-spektroskopischer Untersuchungen konnten acht verschiedene Kristallformen identifiziert werden.[3] Die Schmelzpunkte der verschiedenen polymorphen Formen liegen bei 134 °C (Form I), 128 °C (Form II), 126 °C (Form III), 124 °C (Form IV), 122 °C (Form V), 120 °C (Form VI), 118 °C (Form VII) und 108±5 °C (Form VIII).[3] Von drei Formen sind die Schmelzenthalpien mit 27,7 kJ·mol−1 (Form I), 28,9 kJ·mol−1 und 23,4 kJ·mol−1 (Form V) bekannt.[3] Eine praktische Relevanz haben allerdings nur die Formen I und III, da nur diese über eine Lösungsmittelkristallisation erhalten werden können.[1] Diese beiden Formen bilden ein enantiotropes System mit einem Umwandlungspunkt bei 42 °C.[13] Unterhalb diese Temperatur und somit bei Raumtemperatur ist Form III die thermodynamisch stabile Form und Form I metastabil. Oberhalb des Umwandlungspunktes kehrt sich das Verhältnis um. Form I wird zur stabilen und Form III zur metastabilen Form. Beide Kristallformen bilden ein monoklines Kristallgitter.[13] Beide Kristallgitter unterscheiden sich hinsichtlich der geometrischen Anordnung der Trifluormethylphenylfunktion zur Benzoesäurefunktion sowie der gebildeten Wasserstoffbrückenbindungen.[2] Die Löslichkeit ist in Wasser bei 37 °C mit 0,0265 g·l−1 nur gering. Bessere Löslichkeiten werden bei 37 °C in Propylenglycol mit 2,239 g·l−1, in Ethanol mit 6,918 g·l−1 und in Chloroform mit 19,055 g·l−1 erreicht. In einem 1:1-Gemisch aus Wasser und Ethanol beträgt die Löslichkeit bei 37 °C 0,224 g·l−1.[5] Mit einem pKS-Wert von 3,85 ist die Verbindung eine mittelstarke Säure.[14]
Handelsnamen[Bearbeiten | Quelltext bearbeiten]
Algesalona (D), Dignodolin (D), Mobilisin (D, I), Mobilat (D), Rheuma Lindofluid (D), Arlef (F, GB), Meralen (GB), Assan Emgel (CH), Assan Gel (CH)
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c M. Kuhnert-Brandstätter, L. Borka, G. Friedrich-Sander: Zur Polymorphie von Arzneimitteln: Flufenaminsäure und BL 191. In: Arch. Pharm. 307 (1974), S. 845–853.
- ↑ a b H. M. Murthy, Krishna, T. N. Bhat, M. Vijayan: Structure of a new crystal form of 2-{[3-(trifluoromethyl)phenyl]amino}benzoic acid (flufenamic acid). In: Acta Cryst. B: Struct. Cryst. Cryst. Chem. 38 (1982), S. 315–317, doi:10.1107/S0567740882002763.
- ↑ a b c d e A. Burger, R. Ramberger: Thermodynamische Beziehungen zwischen polymorphen Modifikationen: Flufenaminsäure und Mefenaminsäure. In: Mikrochim. Acta. 73 (1980), S. 17–28, doi:10.1007/BF01197228.
- ↑ T. Konno: Physical and Chemical Changes of Medicinicals in Mixtures with Adsorbents in the Solid State. III. Determination of Vapor Pressure of Solid Drugs by Steam Distillation. In: Chem. Pharm. Bull. 38 (1990), S. 1032–1034, doi:10.1248/cpb.38.1032, pdf.
- ↑ a b J. Priborski, K. Takayama, Y. Obata, Z. Priborska, T. Nagai: Influence of Limonene and Laurocamram on Percutaneous Adsorption of Nonsteroidal Anti-infammatory Drugs. In: Arzneim.-Forsch./Drug Res. 42 (1992), S. 116–119.
- ↑ a b Datenblatt Flufenamic acid bei Sigma-Aldrich, abgerufen am 18. Mai 2017 (PDF).
- ↑ a b c d A. Kleemann, J. Engel, B. Kutscher, D. Reichert: Pharmaceutical Substances – Synthesis, Patents, Applications. 4. Auflage. (2000), Thieme-Verlag Stuttgart, ISBN 978-1-58890-031-9.
- ↑ Wolf-Dieter Müller-Jahncke, Christoph Friedrich, Ulrich Meyer: Arzneimittelgeschichte. 2., überarb. und erw. Auflage. Wiss. Verl.-Ges, Stuttgart 2005, ISBN 978-3-8047-2113-5.
- ↑ R. B. Moffett, B. D. Aspergren: Aminoalkylphenothiazines. In: J. Am. Chem. Soc. 82 (1960), S. 1600–1607, doi:10.1021/ja01492a022.
- ↑ R. Carrasco, R. F. Pellon, J. Elguero, P. Goya, J. A. Paez: The Use of Ultrasound in the Synthesis of N-Thranilic Acids by the Ullmann Goldberg Reaction. In: Synth. Comm. 19 (1989), S. 2077–2080, doi:10.1080/00397918908052600.
- ↑ J. S. Kaltenbronn, R. A. Scherrer, F. W. Short, E. M. Jones, H. R. Beatty: Arzneim. Forsch./Drug Res. 33 (1983), S. 621–627.
- ↑ J. H. Wilkinson, I. L. Finar: A study of the properties of fluorine-substituted 5-aminoacridines and related compounds. Part II: 5-Amino-2-and -4-trifluoromethyl acridines. In: J. Chem. Soc. 1948, S. 32–35, doi:10.1039/JR9480000032.
- ↑ a b X. Chen, T. Li, K. R. Morris, S.R. Byrn: Crystal Packing and Chemical Reactivity of Two Polymorphs of Flufenamic Acid with Ammonia. In: Mol. Cryst. Liq. Cryst. 381 (2002), S. 121–131.
- ↑ H. Terada, S. Muraoka, T. Fujita: Structure-Activity Relationship of Fenamic Acids. In: J. Med. Chem. 17 (1974), S. 330–334.