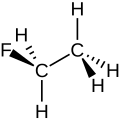
Fluorethan
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Darstellung in Skelettformel-Schreibweise | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Fluorethan | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C2H5F | |||||||||||||||
| Kurzbeschreibung |
extrem entzündbares Gas[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 48,06 g·mol−1 | |||||||||||||||
| Aggregatzustand |
gasförmig[1] | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
−37,1 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
wenig löslich in Wasser[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Treibhauspotential |
4 (bezogen auf 100 Jahre)[2] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Fluorethan ist eine chemische Verbindung aus der Gruppe der gesättigten Fluorkohlenwasserstoffe.
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Fluorethan kann durch Reaktion von Ethen mit Fluorwasserstoff oder durch Reaktion von Chlorethan mit Silber(I)-fluorid gewonnen werden.[3]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Fluorethan ist ein extrem entzündbares Gas, das wenig löslich in Wasser ist. Es zersetzt sich bei Erhitzung, wobei unter anderem Fluorwasserstoff entsteht. Seine kritische Temperatur liegt bei 102,3 °C, der kritische Druck bei 50,3 bar und die kritische Dichte bei 0,8176 g/cm3.[1]
Fluorethan bildet entzündliche Dampf-Luft-Gemische. Der Explosionsbereich liegt zwischen 5 Vol.‑% (100 g/m3) als untere Explosionsgrenze (UEG) und 10 Vol.‑% (200 g/m3) als obere Explosionsgrenze (OEG).[1]
Das Fluorethan-Molekül kann mit unterschiedlichen Formelschreibweisen dargestellt werden:
Verwendung[Bearbeiten | Quelltext bearbeiten]
Fluorethan kann als Kältemittel verwendet werden,[4] hat aber aufgrund seiner Eigenschaften praktisch keine industrielle Bedeutung.[5]
Sicherheitshinweise[Bearbeiten | Quelltext bearbeiten]
Fluorethan bildet mit Luft ein explosionsfähiges Gemisch.[1]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f g h i j k l m n Eintrag zu CAS-Nr. 353-36-6 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 28. Oktober 2019. (JavaScript erforderlich)
- ↑ G. Myhre, D. Shindell et al.: Climate Change 2013: The Physical Science Basis. Working Group I contribution to the IPCC Fifth Assessment Report. Hrsg.: Intergovernmental Panel on Climate Change. 2013, Chapter 8: Anthropogenic and Natural Radiative Forcing, S. 24–39; Table 8.SM.16 (ipcc.ch [PDF]).
- ↑ P. B. Saxena: I.I.T. Chemistry. 2008, S. O-218 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Jiangtao Wu, Yong Zhou: An Equation of State for Fluoroethane (R161). In: International Journal of Thermophysics. 33, 2012, S. 220–234, doi:10.1007/s10765-011-1151-3.
- ↑ Peter Fabian, Onkar N. Singh: Reactive Halogen Compounds in the Atmosphere. Springer, 1999, ISBN 3-540-64090-8, S. 87 (eingeschränkte Vorschau in der Google-Buchsuche).