Formylfluorid
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
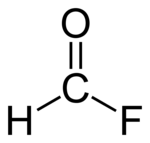
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Formylfluorid | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | CHFO | ||||||||||||
| Kurzbeschreibung |
farbloses Gas[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 48,02 g·mol−1 | ||||||||||||
| Aggregatzustand |
gasförmig[1] | ||||||||||||
| Dichte |
1,195 g·cm−3 (− 30 °C)[1] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Siedepunkt |
−26,5 °C[1] | ||||||||||||
| Löslichkeit |
| ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Formylfluorid ist eine chemische Verbindung aus der Gruppe der Carbonsäurehalogenide.
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Formylfluorid kann durch Reaktion von Benzoylchlorid mit einer Kaliumfluoridlösung in Ameisensäure gewonnen werden. Das Reaktionsgemisch wird dazu erwärmt und die entwickelten Gase in einer mit Trockeneis gekühlten Vorlage kondensiert.[2] Im Allgemeinen ist die Verbindung durch Reaktion von Ameisensäure mit einem Fluorierungsmittel (wie zum Beispiel Benzoylchlorid/Kaliumfluorid, Benzoylfluorid und Cyanurfluorid) darstellbar. Auch weitere Syntheseverfahren sind bekannt.[4]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Formylfluorid ist ein farbloses Gas.[1] Unter dem Siedepunkt ist es eine leicht bewegliche, farblose Flüssigkeit, die intensiv, etwas an Schwefeldioxid und auch an Acetylfluorid erinnernd, riecht. In Wasser löst sich die Verbindung unter langsamer Hydrolyse. In Ethanol löst sie sich unter Bildung von Ameisensäureethylester. Sie ist beständig bei tiefen Temperaturen, zerfällt jedoch bei Zimmertemperatur im Verlauf von einigen Stunden allmählich unter Bildung von Kohlenmonoxid und Fluorwasserstoff.[2] Das Molekül hat eine planare Struktur.[5]
Verwendung[Bearbeiten | Quelltext bearbeiten]
Formylfluorid kann als Formylierungsreagenz für aromatische Kohlenwasserstoffe, Alkohole und Phenole verwendet werden.[6][4][7] Mit Bortrifluorid bildet es einen Komplex der als Formylierungsreagenz bei elektrophilen aromatischen Substitutionsreaktionen eingesetzt werden kann.[8]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f CRC Handbook of Chemistry and Physics. CRC Press, ISBN 978-1-4822-0868-9, S. 278 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c d e A. N. Nesmejanow, E. J. Kahn: Über die unmittelbare Synthese von Säure‐fluoriden aus Säuren und die Herstellung von Formylfluorid. In: Berichte der deutschen chemischen Gesellschaft (A and B Series). Band 67, Nr. 3, 1934, S. 370–373, doi:10.1002/cber.19340670303.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b George A. Olah, G. K. Surya Prakash, Qi Wang, Xing-ya Li: Encyclopedia of Reagents for Organic Synthesis. John Wiley & Sons, Ltd, Chichester, UK 2001, ISBN 978-0-471-93623-7, Formyl Fluoride, doi:10.1002/047084289x.rf027.
- ↑ Y.J. Xu, J.W.C. Johns, A.R.W. Mckellar: High-Resolution Infrared Spectra of Formyl Fluoride, HFCO. In: Journal of Molecular Spectroscopy. Band 168, Nr. 1, 1994, S. 147–157, doi:10.1006/jmsp.1994.1267.
- ↑ J. Buckingham: Dictionary of Organic Compounds. Chapman & Hall, 1996, ISBN 978-0-412-54090-5, S. 3242 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ G. A. Olah, S. J. Kuhn: Formylation with Formyl Fluoride: A New Aldehyde Synthesis and Formylation Method 1. In: Journal of the American Chemical Society. Band 82, Nr. 9, 1960, S. 2380–2382, doi:10.1021/ja01494a065.
- ↑ Metin Balcı: Reaction Mechanisms in Organic Chemistry. Wiley, 2021, ISBN 978-3-527-34964-7, S. 339 (eingeschränkte Vorschau in der Google-Buchsuche).