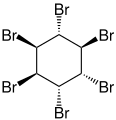
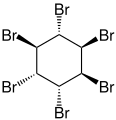
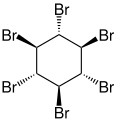
Hexabromcyclohexan
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Ohne Stereochemie | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Hexabromcyclohexan | ||||||||||||||||||
| Andere Namen |
1,2,3,4,5,6-Hexabromcyclohexan (IUPAC) | ||||||||||||||||||
| Summenformel | C6H6Br6 | ||||||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 557,55 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Dichte |
3,24 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Hexabromcyclohexan, genauer 1,2,3,4,5,6-Hexabromcyclohexan, ist der Name eines komplexen Gemischs von verschiedenen isomeren chemischen Verbindungen aus der Gruppe der Halogenkohlenwasserstoffe.[3]
Darstellung[Bearbeiten | Quelltext bearbeiten]
Die Synthese von Hexabromcyclohexan erfolgt durch die Bromierung von Benzol unter Lichteinwirkung. Dabei entstehen im Wesentlichen zwei Isomere von Hexabromcyclohexan – (–)-α/(+)-α und β – und unter bestimmten Bedingungen als Nebenprodukt auch 1,4-Dibrombenzol.[4] Diese Synthesemethode wurde bereits im frühen 19. Jahrhundert von Wissenschaftlern wie Michael Faraday und Eilhard Mitscherlich entwickelt, wobei Faraday sich nur mit dem Chlor-Analogon Hexachlorcyclohexan beschäftigte, nicht mit der Bromverbindung.[5][6][7]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
In der Konfiguration e.e.e.e.p.p ((–)-α- und (+)-Isomer) beträgt der Schmelzpunkt 222 °C.[8] Das θ-Isomer (aeaeee) ist die stabilste Form.[9] Die Verbindung kristallisiert in einer monoklinen Kristallstruktur mit der Raumgruppe P21/n (Raumgruppen-Nr. 14, Stellung 2).[2]
Es ist ein starker Inhibitor der Autophosphorylierung der JAK2-Tyrosinkinase. Es spielt eine Rolle als EC 2.7.10.2, unspezifische Protein-Tyrosin-Kinase-Inhibitor.[10][11]
Stereoisomere[Bearbeiten | Quelltext bearbeiten]
Siehe auch[Bearbeiten | Quelltext bearbeiten]
Weblinks[Bearbeiten | Quelltext bearbeiten]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e Datenblatt JAK2 Inhibitor II bei Sigma-Aldrich, abgerufen am 20. Dezember 2023 (PDF).
- ↑ a b R. M. Carman, A. C. Garner, W. T. Robinson: α-1,2,3,4,5,6-Hexabromocyclohexane. In: Australian Journal of Chemistry. Band 47, Nr. 7, 1994, S. 1395–1399, doi:10.1071/ch9941395.
- ↑ a b W. L. F. Armarego: Purification of Laboratory Chemicals: Part 2 Inorganic Chemicals, Catalysts, Biochemicals, Physiologically Active Chemicals, Nanomaterials. Butterworth-Heinemann, 2022, ISBN 978-0-323-95828-8, S. 656 (Google Books).
- ↑ R. Zbinden: Ultrarotspektren und Struktur von α- und β-Hexabromcyclohexan. In: Helvetica Physica Acta. Band 26, Nr. 2, 15. Mai 1953, S. 129–144, doi:10.5169/SEALS-112404.
- ↑ Alastair J. Durie, Alexandra M. Z. Slawin, Tomas Lebl, David O'Hagan: The Synthesis of η‐1,2,3,4,5,6‐Hexafluorocyclohexane (Benzene Hexafluoride) from Benzene. In: Angewandte Chemie. Band 124, Nr. 40, 2012, S. 10233–10235, doi:10.1002/ange.201205577.
- ↑ M. Faraday: XXVI. On new compounds of carbon and hydrogen, and on certain other products obtained during the decomposition of oil by heat. In: Philosophical Magazine. Band 66, Nr. 329, 30. September 1825, S. 180–197, doi:10.1080/14786442508673946.
- ↑ E. Mitscherlich: Chlorbenzin und Chlorbenzid. In: Annalen der Physik. Band 111, Nr. 6, Januar 1835, S. 370–374, doi:10.1002/andp.18351110615.
- ↑ Randolph Riemschneider: Zur Chemie von Polyhalocyclohexanen. Mitt. XXIII: 1.2.3.4.5.6-Hexa(hetero)halocyclohexane der Konfiguration e.e.e.e.p.p. In: Zeitschrift für Naturforschung B. Band 8, Nr. 12, 1. Dezember 1953, S. 701–705, doi:10.1515/znb-1953-1201.
- ↑ V. Umadevi, N. Santhanamoorthi, L. Senthilkumar: Understanding molecular properties of halogenated cyclohexane – A DFT study. In: Computational and Theoretical Chemistry. Band 1049, 2014, S. 55–61, doi:10.1016/j.comptc.2014.09.019.
- ↑ 1,2,3,4,5,6-hexabromocyclohexane (CHEBI:93940). In: ChEBI. Abgerufen am 19. Dezember 2023.
- ↑ 1,2,3,4,5,6-Hexabromocyclohexane. In: PubChem. Abgerufen am 19. Dezember 2023 (englisch).