Isocytosin
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Isocytosin | |||||||||||||||
| Andere Namen |
2-Amino-pyrimidin-4-on | |||||||||||||||
| Summenformel | C4H5N3O | |||||||||||||||
| Kurzbeschreibung |
weiße Prismen[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 111,10 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
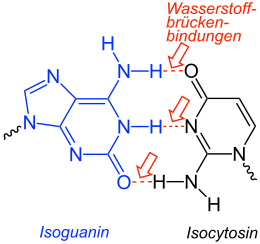
Isocytosin ist eine heterocyclische organische Verbindung mit einem Pyrimidingrundgerüst. Es ist ein Isomer der Nukleinbase Cytosin, wobei Aminogruppe und Carbonylgruppe die Plätze tauschen. Es ist unter anderem Bestandteil der Nukleoside Isocytidin und Pseudoisocytidin.
Darstellung[Bearbeiten | Quelltext bearbeiten]
Isocytosin lässt sich durch Kondensation von Guanidinhydrochlorid mit 3-Oxopropansäure („Formylessigsäure“, C3H4O3)[S 1] erhalten. Die C3-Komponente ist jedoch in diesem Fall nicht lagerfähig und wurde daher durch Äpfelsäure ersetzt. Diese wird in konzentrierter Schwefelsäure unter Wasserabspaltung decarbonyliert, verliert also Kohlenmonoxid. Die in situ gebildete 3-Oxopropansäure kondensiert mit dem Guanidin in der schwefelsauren Lösung unter zweifacher Abspaltung von Wasser.[1]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Isocytosin bildet weiße Prismen mit einem Schmelzpunkt von 276 °C.[1] Es ist tautomer und kristallisiert im 1:1-Verhältnis einer 1H- und einer 3H-Variante.[3]
Verwendung[Bearbeiten | Quelltext bearbeiten]
Isocytosin wird zusammen mit Isoguanin zur Untersuchung von ungewöhnlichen Basenpaarungen in der DNA herangezogen.[4][5][6]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d William T. Caldwell, Harry B. Kime: „A New Synthesis of Isocytosine“, J. Am. Chem. Soc., 1940, 62 (9), S. 2365–2365 (doi:10.1021/ja01866a028).
- ↑ a b Datenblatt Isocytosine, ≥99% bei Sigma-Aldrich, abgerufen am 31. Oktober 2013 (PDF).
- ↑ Martin Dračínský, Petr Jansa, Kari Ahonen, Miloš Buděšínský: „Tautomerism and the Protonation/Deprotonation of Isocytosine in Liquid- and Solid-States Studied by NMR Spectroscopy and Theoretical Calculations“, European Journal of Organic Chemistry, 2011, 2011 (8), S. 1544–1551 (doi:10.1002/ejoc.201001534).
- ↑ Andrzej Jaworski, Józef S. Kwiatkowski, Bogdan Lesyng: „Why isoguanine and isocytosine are not the components of the genetic code“, International Journal of Quantum Chemistry, Supplement: Proceedings of the International Symposium on Quantum Biology and Quantum Pharmacology, 1985, 28 (Supplement S12), S. 209–216 (doi:10.1002/qua.560280720).
- ↑ Christopher Roberts, Rajanikanth Bandaru, Christopher Switzer: „Theoretical and Experimental Study of Isoguanine and Isocytosine: Base Pairing in an Expanded Genetic System“, J. Am. Chem. Soc., 1997, 119 (20), S. 4640–4649 (doi:10.1021/ja970123s).
- ↑ Xiang-Lei Yang, Hiroshi Sugiyama, Shuji Ikeda, Isao Saito, Andrew H.-J. Wang: „Structural Studies of a Stable Parallel-Stranded DNA Duplex Incorporating Isoguanine:Cytosine and Isocytosine:Guanine Basepairs by Nuclear Magnetic Resonance Spectroscopy“, Biophys. J., 1998, 75 (3), S. 1163–1171 (PMID 9726918; PMC 1299791 (freier Volltext); doi:10.1016/S0006-3495(98)74035-4).