Jasmon
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Jasmon | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C11H16O | ||||||||||||||||||
| Kurzbeschreibung |
farblose, viskose Flüssigkeit[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 164,24 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Brechungsindex |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Jasmon ist eine chemische Verbindung aus der Stoffgruppe der Cyclopentenone, Sie ist ein wesentlicher Bestandteil des Duftstoffs der Jasminblüten, der bereits von den Römern zur Parfümherstellung verwendet wurde.
Die Konstitution der Verbindung wurde 1933 unabhängig voneinander sowohl von Leopold Ružička[3] als auch in einer Veröffentlichung des wissenschaftlichen Labors der Firma Heine & Co.[5] beschrieben und mit einer 1935 publizierten Synthese bestätigt.[6] 1952 konnte der Beleg erbracht werden, dass es sich bei dem natürlich vorkommenden Jasmon um das cis-Isomer handelt.[7]
Darstellung[Bearbeiten | Quelltext bearbeiten]
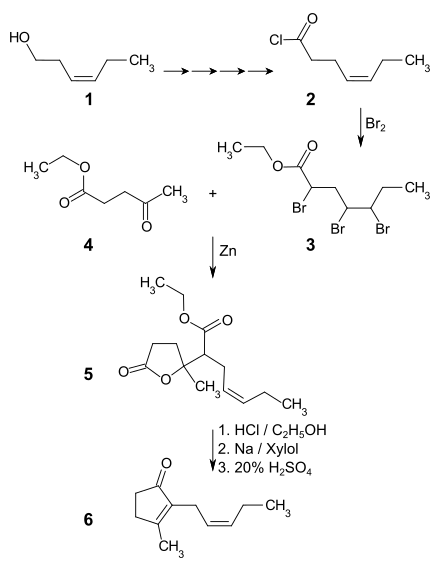
Als Ausgangsmaterial für die erste Synthese von Jasmon wurde cis-3-Hexenol 1 aus dem japanischen Pfefferminzöl verwendet. Dieses wird über die Zwischenstufen cis-3-Hexenbromid, cis-3-Hexennitril und cis-3-Hexencarbonsäure in das cis-3-Hexencarbonsäurechlorid 2 überführt. Das Säurechlorid wird an der Doppelbindung und benachbart zur Chlorcarbonylgruppe bromiert und mit Ethanol in den Tribromethylester 3 überführt. Die Umsetzung von 3 mit Lävulinsäureethylester 4 in Benzol und mit Iod aktiviertem Zink in einer Reformatzki-Reaktion ergibt das Lacton 5, wobei gleichzeitig durch eine Debromierung die Doppelbindung in der Seitenkette zurückgebildet wird. Das Lacton wird zunächst mit Chlorwasserstoff in Ethanol und das Reaktionsprodukt anschließend mit Natrium in Xylol umgesetzt. Nach dem Erhitzen mit 20%iger Schwefelsäure erhält man ein Rohprodukt, das man als Semicarbazon durch Umkristallisieren gereinigt wird und aus dem mit 10%iger Schwefelsäure das cis-Jasmon 6 freigesetzt werden kann.[6]
Isomerie[Bearbeiten | Quelltext bearbeiten]

Das isomere trans-Jasmon[8] kann als Begleitstoff zum natürlich vorkommenden cis-Isomer auftreten und kann insbesondere in synthetisch hergestelltem Jasmon als Bestandteil vorliegen.[9]
Vorkommen[Bearbeiten | Quelltext bearbeiten]

cis-Jasmon kommt in den Blüten von Jasmin vor. Die Verbindung kann im amerikanischen, russischen, italienischen und bulgarischen, jedoch nicht im japanischen Pfefferminzöl nachgewiesen werden.[10]
Biologische Bedeutung[Bearbeiten | Quelltext bearbeiten]
Bei Pflanzen ist cis-Jasmon in die Abwehrstrategie gegen Insekten einbezogen. Es wird freigesetzt, falls Insekten die Pflanzen befallen. So lockt es Fraßfeinde der Insekten (z. B. der Blattläuse) an. Gleichzeitig soll die Verbindung die Fruchtbarkeit der Insekten stören.[11]
Siehe auch[Bearbeiten | Quelltext bearbeiten]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Eintrag zu CIS-JASMONE in der CosIng-Datenbank der EU-Kommission, abgerufen am 16. März 2020.
- ↑ a b c d Datenblatt Jasmon bei Sigma-Aldrich, abgerufen am 16. März 2020 (PDF).
- ↑ a b c d L. Ruzicka, M. Pfeiffer: Über Jasminriechstoffe I. Die Konstitution des Jasmons. In: Helvetica Chimica Acta. Band 16, Nr. 1, 1933, S. 1208–1214, doi:10.1002/hlca.193301601153.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-366.
- ↑ W. Treff, H. Werner: Über die Konstitution des Jasmons. In: Berichte der deutschen chemischen Gesellschaft. Band 66, Nr. 10, 11. Oktober 1933, S. 1521–1527, doi:10.1002/cber.19330661014.
- ↑ a b W. Treff, H. Werner: Über die Synthese des Jasmons. In: Berichte der deutschen chemischen Gesellschaft. Band 68, Nr. 4, 3. April 1935, S. 640–644, doi:10.1002/cber.19350680415.
- ↑ Leslie Crombie, Stanley H. Harper: Experiments on the synthesis of the pyrethrins. Part VIII. Stereochemistry of jasmone and identity of dihydropyrethrone. In: Journal of the Chemical Society. 1952, S. 869, doi:10.1039/jr9520000869.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu (E)-Jasmon: CAS-Nummer: 6261-18-3, EG-Nummer: 228-410-7, ECHA-InfoCard: 100.025.828, PubChem: 1549019, ChemSpider: 1266013, Wikidata: Q27160475.
- ↑ Ernst Steinegger, Rudolf Hänsel: Lehrbuch der Pharmakognosie und Phytopharmazie. 4. Auflage. Springer Verlag, Berlin, Heidelberg 1988, ISBN 978-3-662-08319-2, S. 341 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Harry Schmidt: Zur Kenntnis des Pfefferminzöls. Vorkommen von Jasmon im ätherischen Öl von Mentha piperita L. In: Chemische Berichte. Band 80, Nr. 6, Dezember 1947, S. 538, doi:10.1002/cber.19470800613.
- ↑ Parfum-Komponente als Pflanzenschutz – Cis-Jasmon lockt Feinde der Saaten-vernichtenden Insekten an, 30. Juli 2002.
