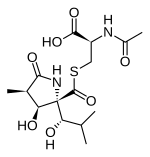
Lactacystin
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Lactacystin | ||||||||||||
| Andere Namen |
(2R)-2-Acetamido-3-[(2R,3S,4R)-3-hydroxy-2-[(1S)-1-hydroxy-2-methylpropyl]-4-methyl-5-oxopyrrolidin-2-carbonyl]sulfanylpropansäure | ||||||||||||
| Summenformel | C15H24N2O7S | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 376,43 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Lactacystin ist eine organische Verbindung, die durch Bakterien der Gattung Streptomyces synthetisiert wird und im Jahr 1991 zuerst beschrieben wurde.[2]
Wirkung[Bearbeiten | Quelltext bearbeiten]
Lactacystin ist ein Proteasom-Inhibitor und inhibiert spezifische katalytische Untereinheiten des Proteasoms. Proteasom ist ein Enzym, das intrazellulär Proteine abbaut und zu den Peptidasen gehört.[3] Damit nimmt es an der Regulation des Zellzyklus teil. Die Steuerung der Proteasomfunktion eignet sich daher potentiell zur Krebstherapie. Lactacystin war der erste nicht-peptidische Proteasom-Inhibitor und wird mittlerweile weitverbreitet in der Biochemie und Zellbiologie eingesetzt.[4]
Synthese[Bearbeiten | Quelltext bearbeiten]
Die erste Totalsynthese von Lactacystin wurde im Jahr 1992 von E. J. Corey entwickelt[5] und später durch eine effiziente und direkte enantioselektive Synthese ergänzt.[6] Mittlerweile haben verschiedene Forschungsgruppen alternative Synthesen entwickelt.[7][8][9][10]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b Datenblatt Lactacystin, ≥90% (HPLC) bei Sigma-Aldrich, abgerufen am 28. Dezember 2013 (PDF).
- ↑ S. Omura, K. Matsuzaki u. a.: Structure of lactacystin, a new microbial metabolite which induces differentiation of neuroblastoma cells. In: The Journal of antibiotics. Band 44, Nummer 1, Januar 1991, S. 117–118, PMID 2001981.
- ↑ G. Fenteany, R. Standaert, W. Lane, S. Choi, E. J. Corey, S. Schreiber: Inhibition of proteasome activities and subunit-specific amino-terminal threonine modification by lactacystin. In: Science. 268, 1995, S. 726–731, doi:10.1126/science.7732382.
- ↑ Do Hee Lee, Alfred L. Goldberg: Proteasome inhibitors: valuable new tools for cell biologists. In: Trends in cell biology 8.10 (1998): S. 397–403, doi:10.1016/S0962-8924(98)01346-4.
- ↑ E. J. Corey, Gregory A. Reichard: Total synthesis of lactacystin. In: Journal of the American Chemical Society. 114, 1992, S. 10677–10678, doi:10.1021/ja00052a096.
- ↑ E. J. Corey, Weidong Li, Tohru Nagamitsu: Eine effiziente und kurze enantioselektive Totalsynthese von Lactacystin. In: Angewandte Chemie 110.12 (1998): S. 1784–1787. doi:10.1002/(SICI)1521-3757(19980619)110:12<1784::AID-ANGE1784>3.0.CO;2-#
- ↑ Nobuhisa Fukuda, Kazuki Sasaki, T. V. R. S. Sastry, Motomu Kanai, Masakatsu Shibasaki: Catalytic Asymmetric Total Synthesis of (+)-Lactacystin. In: The Journal of Organic Chemistry. 71, 2006, S. 1220–1225, doi:10.1021/jo0524223.
- ↑ Timothy J. Donohoe, Herman O. Sintim, Leena Sisangia, Karl W. Ace, Paul M. Guyo: Utility of the Ammonia-Free Birch Reduction of Electron-Deficient Pyrroles: Total Synthesis of the 20S Proteasome Inhibitor,clasto-Lactacystin β-Lactone. In: Chemistry - A European Journal. Band 11, Nr. 14, 4. Juli 2005, S. 4227–4238, doi:10.1002/chem.200401119.
- ↑ Masakatsu Shibasaki, Motomu Kanai, Nobuhisa Fukuda: Total Synthesis of Lactacystin and Salinosporamide A. In: Chemistry – An Asian Journal. Band 2, Nr. 1, 8. Januar 2007, S. 20–38, doi:10.1002/asia.200600310.
- ↑ Shun Yoshioka, Masanori Nagatomo, Masayuki Inoue: Application of Two Direct C(sp 3 )–H Functionalizations for Total Synthesis of (+)-Lactacystin. In: Organic Letters. Band 17, Nr. 1, 2. Januar 2015, S. 90–93, doi:10.1021/ol503291s.