Lithiummangan(III,IV)-oxid
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
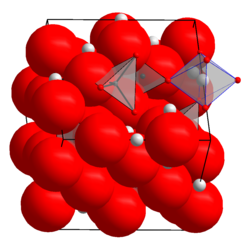
| ||||||||||||||||
| _ Li+ _ Mn3+/4+ _ O2− | ||||||||||||||||
| Kristallsystem |
kubisch | |||||||||||||||
| Raumgruppe |
Fd3m (Nr. 227) | |||||||||||||||
| Gitterparameter |
a = 8,2476 Å | |||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Lithiummangan(III,IV)-oxid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Verhältnisformel | LiMn2O4 | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 180,81 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[2] | |||||||||||||||
| Dichte |
4,1 g·cm−3 (25 °C)[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Lithiummangan(III,IV)-oxid (LMO) ist eine anorganische chemische Verbindung aus der Gruppe der Oxide mit der Summenformel LiMn2O4. Neben dieser sind mit Li1+xMn2-xO4, Li2Mn2O4, Li2MnO3, Li2Mn4O9 and Li4Mn5O12 im Li–Mn–O-Phasendiagramm noch weitere Lithiummanganoxide bekannt.[4]
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Lithiummangan(III,IV)-oxid kann durch Reaktion von Lithium, Lithiumhydroxid oder Lithiumcarbonat mit Mangan(IV)-oxid gewonnen werden.[5][6]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Lithiummangan(III,IV)-oxid ist ein schwarzer Feststoff,[2] der praktisch unlöslich in Wasser ist.[3] Er besitzt eine kubische Kristallstruktur vom Spinelltyp mit der Raumgruppe Fd3m (Raumgruppen-Nr. 227) (a = 8,2476 Å), die aus einer kubisch-dichtesten Kugelpackung von Oxidionen mit Lithiumionen in einem Achtel der Tetraederlücken und Manganionen in der Hälfte der Oktaederlücken besteht.[7][6]
Verwendung[Bearbeiten | Quelltext bearbeiten]
Lithiummangan(III,IV)-oxid wird als Elektrodenmaterial für Lithium-Ionen-Akkumulatoren verwendet.[2] Allerdings spricht die niedrige Zyklenstabilität der Verbindung eher für Lithiumcobaltoxid Li1-xCoO2 als Material. Durch Dotierung mit zweiwertigen Übergangsmetallkationen kann die Verbindung für diesen Einsatz stabilisiert werden.[8]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Peter Kurzweil, Otto K. Dietlmeier: Elektrochemische Speicher Superkondensatoren, Batterien, Elektrolyse-Wasserstoff, Rechtliche Grundlagen. Springer-Verlag, 2016, ISBN 978-3-658-10900-4, S. 189 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c d e f g h Datenblatt Lithium manganese oxide bei Sigma-Aldrich, abgerufen am 22. Mai 2017 (PDF).
- ↑ a b c Datenblatt Lithium manganese(III,IV) oxide bei Alfa Aesar, abgerufen am 25. März 2017 (Seite nicht mehr abrufbar).
- ↑ Eriksson, Tom: LiMn2O4 as a Li-ion Battery Cathode. From Bulk to Electrolyte Interface, abgerufen am 25. März 2017. urn:nbn:se:uu:diva-1397.
- ↑ Chuanyun Wan, Yanna Nuli, Jihua Zhuang, Zhiyu Jiang: Synthesis of spinel LiMn2O4 using direct solid state reaction. In: Materials Letters. 56, 2002, S. 357, doi:10.1016/S0167-577X(02)00485-8.
- ↑ a b Christian Julien, Alain Mauger, Ashok Vijh, Karim Zaghib: Lithium Batteries Science and Technology. Springer, 2015, ISBN 978-3-319-19108-9, S. 176 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Junji Akimoto, Yasuhiko Takahashi, Yoshito Gotoh, Susumu Mizuta: Single Crystal X-ray Diffraction Study of the Spinel-type LiMn2O4. In: Chemistry of Materials. 12, 2000, S. 3246, doi:10.1021/cm0003673.
- ↑ Thorsten Buhrmester: Zur Fehlordnung im System Li1+xMn2−yO4-z, Dissertation 2001
