Martinet-Reaktion
Die Martinet-Reaktion oder auch Martinet-Dioxindolsynthese ist eine Namensreaktion der organischen Chemie. Sie wurde nach ihrem französischen Entdecker Joseph Martinet benannt, der die Reaktion 1913 veröffentlichte.[1] Mit Hilfe der Reaktion lassen sich Dioxindol (manchmal auch Indolinon genannt)[2] und dessen Derivate herstellen.[1][3][4]
Übersichtsreaktion[Bearbeiten | Quelltext bearbeiten]
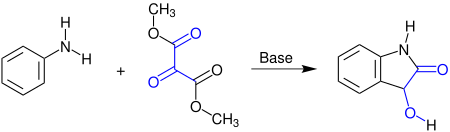
Die Martinet-Reaktion findet in der Abwesenheit von Sauerstoff statt. Bei dieser Namensreaktion reagiert Anilin mit Methyl- oder Ethylestern der Mesoxalsäure zu 1H-Indolin-2-on, einem Dioxindol:[1]
Statt Anilin kann auch ein N-Alkylanilin oder ein ähnliches Arylamin eingesetzt werden. Das Produkt ist ein racemisches Gemisch des Dioxindols, da im Verlauf des Reaktionsmechanismus an dem Kohlenstoffatom der Hydroxygruppe ein Stereozentrum entsteht.
Mechanismus[Bearbeiten | Quelltext bearbeiten]
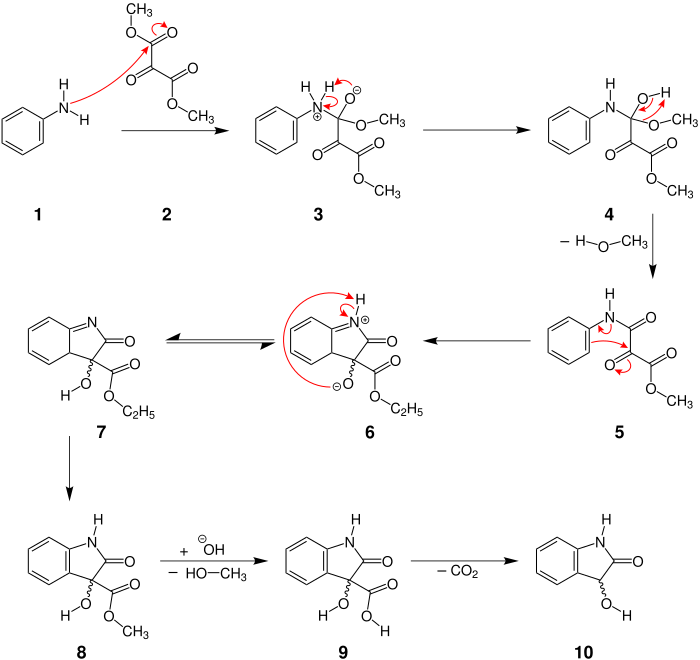
Der Mechanismus wird hier am Beispiel der Reaktion zwischen Anilin und Mesoxalsäuredimethylester dargestellt.[1]
Zu Beginn greift die Aminogruppe des Anilins 1 die Carbonylgruppe des Mesoxalsäuredimethylesters (2) an. Danach wird ein Proton vom Stickstoff zum Sauerstoff 3 übertragen und eine Alkoholgruppe 4 gebildet. Unter Ausbildung einer Ketogruppe wird aus 4 Methanol abgespalten. Nun greift der Aromat die partiell positiv geladene Carbonylgruppe 5 an und bildet damit einen Fünfring 6. Anschließend wird erneut ein Proton übertragen. Von Molekül 7 zu 8 erfolgt eine Isomerisierung, was zu einer Rearomatisierung des Sechsrings 8 führt. Die Zugabe einer Base leitet eine Verseifungsreaktion ein, was eine erneute Abspaltung von Methanol zur Folge hat 9. Außerdem wird aus der Methylestergruppe eine Carboxygruppe 9. Nach einer Abschließenden Decarboxylierung erhält man das Produkt 10 in Form eines racemischen Dioxindols [hier: eines 1H-Indolin-2-ons(10)].
Wird die Reaktion an der Luft (also in Gegenwart von Sauerstoff) durchgeführt, reagiert das entstanden Dioxindol 10 noch weiter zu Isatin (11):
![Weiteroxidation des Dioxindols[5]](//upload.wikimedia.org/wikipedia/commons/thumb/1/17/Martinet-Reaktion_Weiteroxidierung-v2.svg/300px-Martinet-Reaktion_Weiteroxidierung-v2.svg.png)
Weiteroxidation des Dioxindols[5]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d Z. Wang (Hrsg.): Comprehensive Organic Name Reactions and Reagents, 3 Volume Set, John Wiley & Sons, Hoboken, New Jersey 2009, S. 1838–1839, ISBN 978-0-471-70450-8.
- ↑ W. C. Sumpter: The Chemistry of Oxindole, Chem. Rev., 1945, 37 (3), S. 443–479 (doi:10.1021/cr60118a003).
- ↑ A. Guyot, J. Martinet: Compt. Rend., 1913, 156, S. 1625.
- ↑ H. Krauch, W. Kunz, E. Nonnenmacher: Reaktionen der organischen Chemie, 5. neu bearbeitete und erweiterte Auflage, Dr. Alfred Hüthig Buch Verlag, Heidelberg 1976, S. 23, ISBN 3-7785-0363-4.
- ↑ W. C. Sumpter, F. M. Miller: The Chemistry of Heterocyclic Compounds, Volume 8, Indole and Carbazole Systems, John Wiley & Sons, Hoboken, New Jersey 2009, S. 112, ISBN 978-0-470-18807-1.
![Weiteroxidation des Dioxindols[5]](http://upload.wikimedia.org/wikipedia/commons/thumb/1/17/Martinet-Reaktion_Weiteroxidierung-v2.svg/300px-Martinet-Reaktion_Weiteroxidierung-v2.svg.png)