Mavacamten
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
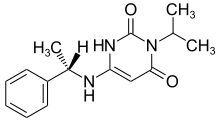
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Freiname | Mavacamten | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C15H19N3O2 | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||
| Wirkmechanismus | ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 273,336 g·mol−1 | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Mavacamten ist ein Arzneistoff aus der Gruppe der Myosin-Inhibitoren. Es ist der erste zugelassene Wirkstoff aus dieser Gruppe und bietet erstmals eine spezifische medikamentöse Behandlung der hypertrophen Kardiomyopathie (HCM).[2]
Im April 2022 erteilte die Food and Drug Administration (FDA) unter dem Namen Camzyos (Bristol-Myers Squibb) die Zulassung für die USA,[3] im April 2023 empfahl die europäische Arzneimittelagentur die Zulassung in der EU.[4]
Die Anwendung erfolgt oral (Einnahme).
Pharmakologische Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Wirkungsmechanismus[Bearbeiten | Quelltext bearbeiten]
Mavacamten moduliert das kardiale Myosin, indem es die Myosin-Aktin-Querbrückenverbindungen blockiert. Diese führen bei der HCM zur Hyperkontraktilität, linksventrikulären Hypertrophie und reduzierten Compliance.[5] Bei Patienten mit der obstruktiven Form der HCM wird dadurch eine Reduktion von objektiv messbaren Befunden wie des Gradienten im linksventrikulären Ausflusstrakt oder der NT-proBNP-Konzentration im Blut erreicht, aber auch die von den Patienten empfundenen Beschwerden wie Atemnot und Herzinsuffizienz-Symptomatik bessern sich.
Studien[Bearbeiten | Quelltext bearbeiten]
In einer Phase-3-Studie (EXPLORER-HCM) wurden 251 Patienten mit hypertropher, obstruktiver Kardiomyopathie über 30 Wochen mit Mavacamten oder Placebo behandelt.[6] In der Verum-Gruppe zeigte sich eine deutliche Verbesserung des Gradienten im linksventrikulären Ausflusstrakt und auch der maximalen Sauerstoffaufnahmekapazität als Maß für die Leistungsfähigkeit des Herz-Kreislauf-Systems. Auch Maßzahlen für die subjektiv empfundenen Beschwerden wie Symptom-Scores oder die NYHA-Klasse besserten sich signifikant gegenüber der Placebo-Gruppe. Nebenwirkungen oder Komplikationen traten nicht häufiger als unter Placebo auf.
In einer Studie an Mäusen wurde auch gezeigt, dass der frühzeitige Einsatz dieses Medikaments die Entwicklung der Hypertrophie und der histologischen Veränderungen des Herzmuskels im Rahmen der HCM bremsen kann.[7]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Asher Mullard: FDA approves first cardiac myosin inhibitor. In: Nature Reviews Drug Discovery. 10. Mai 2022, doi:10.1038/d41573-022-00087-1, PMID 35538237.
- ↑ U.S. Food and Drug Administration Approves Camzyos™ (mavacamten) for the Treatment of Adults With Symptomatic New York Heart Association Class II-III Obstructive Hypertrophic Cardiomyopathy (HCM) to Improve Functional Capacity and Symptoms, www.businesswire.com, 28. April 2022.
- ↑ Camzyos, opinion ( des vom 29. April 2023 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis., Ausschuss für Humanarzneimittel der europäischen Arzneimittelagentur, 26. April 2023.
- ↑ Albree Tower-Rader, Jay Ramchand, Steve E. Nissen, Milind Y. Desai: Mavacamten: a novel small molecule modulator of β-cardiac myosin for treatment of hypertrophic cardiomyopathy. In: Expert Opinion on Investigational Drugs. Band 29, Nr. 11, 2020, S. 1171–1178, doi:10.1080/13543784.2020.1821361.
- ↑ Iacopo Olivotto, Artur Oreziak, Roberto Barriales-Villa, Theodore P. Abraham, Ahmad Masri, Pablo Garcia-Pavia et al.: Mavacamten for treatment of symptomatic obstructive hypertrophic cardiomyopathy (EXPLORER-HCM): a randomised, double-blind, placebo-controlled, phase 3 trial. In: The Lancet. Band 396, Nr. 10253, 2020, S. 759–769, doi:10.1016/S0140-6736(20)31792-X.
- ↑ Eric M. Green, Hiroko Wakimoto, Robert L. Anderson, Marc J. Evanchik, Joshua M. Gorham, Brooke C. Harrison, Marcus Henze, Raja Kawas, Johan D. Oslob, Hector M. Rodriguez, Yonghong Song, William Wan, Leslie A. Leinwand, James A. Spudich, Robert S. McDowell, J. G. Seidman, Christine E. Seidman: A small-molecule inhibitor of sarcomere contractility suppresses hypertrophic cardiomyopathy in mice. In: Science. Band 351, Nr. 6273, 2016, S. 617–621, doi:10.1126/science.aad3456.