Methylazid
Zur Navigation springen
Zur Suche springen
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
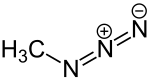
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Methylazid | ||||||||||||
| Andere Namen |
Azidomethan | ||||||||||||
| Summenformel | CH3N3 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 57,05 g·mol−1 | ||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||
| Dichte |
0,869 g·cm−3[2] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Methylazid ist eine chemische Verbindung aus der Gruppe der Azide mit der Summenformel CH3N3. Es wird durch eine Methylierung von Natriumazid zum Beispiel mit Dimethylsulfat[4] hergestellt. Die erste Synthese wurde von Otto Dimroth und Gustav Wilhelm Wislicenus 1905 beschrieben.[1]
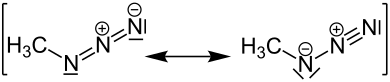
Mesomere Grenzstrukturen[Bearbeiten | Quelltext bearbeiten]
Man kann mehrere mesomere Grenzstrukturen des Methylazids zeichnen:
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Die Verbindung ist gegenüber Erhitzung relativ stabil, so zersetzt sie sich nur langsam bei 200 °C, jedoch explosiv bei 500 °C.[5] Die Zersetzung erfolgt in einer Reaktion erster Ordnung, wobei Stickstoff und Methylnitren als primäre Produkte gebildet werden:[6]
Sicherheitshinweis[Bearbeiten | Quelltext bearbeiten]
Methylazid ist explosiv[7] und besitzt eine hohe Schlagempfindlichkeit.
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b Otto Dimroth, Wilhelm Wislicenus: Über das Methylazid. In: Berichte der deutschen chemischen Gesellschaft. 38, Nr. 2, 1905, S. 1573–1576.
- ↑ W. M. Haynes (Hrsg.): CRC handbook of chemistry and physics. A ready-reference book of chemical and physical data. Begründet von David R. Lide. 93. Auflage. CRC Press, Boca Raton 2012, ISBN 978-1-4398-8049-4, S. 3–356 (englisch, eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Robert H. Hill, David Finster: Laboratory Safety for Chemistry Students. John Wiley & Sons, 2011, ISBN 1-118-21264-9, S. Kapitel 3.2.2.1 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Serban Moldoveanu: Pyrolysis of Organic Molecules: Applications to Health and Environmental Issues. Elsevier, 2009, ISBN 0-08-093215-0, S. 392 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Darwent B. O’Dell: Thermal decomposition of methyl azide. In: Canadian Journal of Chemistry. 48 (7), 1970, S. 1140–1147, doi:10.1139/v70-187.
- ↑ P. G. Urben: Bretherick's handbook of reactive chemical hazards.