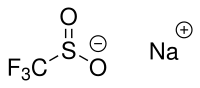
Natriumtrifluormethylsulfinat
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Natriumtrifluormethylsulfinat | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | CF3NaO2S | ||||||||||||||||||
| Kurzbeschreibung |
weißes Pulver[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 156,06 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Löslichkeit |
löslich in Wasser[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Natriumtrifluormethylsulfinat, auf Grund der Pionierarbeiten durch Bernard R. Langlois auch Langlois’ Reagenz genannt, ist ein organisches Salz, das zur Einführung von Trifluormethylgruppen genutzt werden kann.
Herstellung[Bearbeiten | Quelltext bearbeiten]
Natriumtrifluormethylsulfinat kann durch Reaktion von Bromtrifluormethan mit Natriumdithionit gewonnen werden.[2] Als Quelle für das kann auch Schwefeldioxid mit Zink oder Natriumformiat dienen.[3]
Zunächst dissoziiert das Dithionit in zwei Radikalanionen:
Das so entstandenen Radikalanion kann nun mit dem Bromtrifluormethan weiterreagieren:
In der Reaktion wird ein Trifluormethylradikal gebildet. Dieses kann in einer Radikalkettenfortpflanzung oder in einer Kettenabbruchreaktion zum gewünschten Trifluormethylsulfinat weiterreagieren:
Verwendung[Bearbeiten | Quelltext bearbeiten]
Natriumtrifluormethylsulfinat kann zur Synthese von Trifluormethansulfonsäure genutzt werden. Dazu wird das Sulfinat zunächst mit Wasserstoffperoxid oxidiert. Anschließende Hydrolyse liefert die Trifluormethansulfonsäure:[3]
Weitere Anwendungen liegen in der Trifluomethylierung. Pionierarbeit leistete Langlois mit der Herstellung von Trifluormethylthioethern.[3][4] Grundlage dieser Transformation ist die Aktivierung des Reagenz durch ein Oxidationsmittel. So wird ein Trifluomethylradikal freigesetzt, welches dann weitere Reaktionen eingehen kann:
Typischerweise wird tert-Butylhydroperoxid als Oxidationsmittel eingesetzt, aber auch Kaliumperoxodisulfat, Diiodpentoxid oder elektrochemische Verfahren können Natriumtrifluormethylsulfinat aktivieren.[3][5] Auf diesem Weg können Heteroaromaten trifluormethyliert werden[6], Boronsäuren[7], Trifluorborate[8] und Acrylsäuren[9] können substituiert werden, eine Addition an Alkene[10], sowie Cyclisierungen[5] können durchgeführt werden.[3]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e Datenblatt Natriumtrifluormethansulfinat bei Sigma-Aldrich, abgerufen am 11. August 2021 (PDF).
- ↑ Marc Tordeux, Bernard Langlois, Claude Wakselman: Reactions of bromotrifluoromethane and related halides. 8. Condensations with dithionite and hydroxymethanesulfinate salts. In: The Journal of Organic Chemistry. Band 54, Nr. 10, Mai 1989, S. 2452–2453, doi:10.1021/jo00271a041.
- ↑ a b c d e B.R. Langlois: Once Upon a Time Was the Langlois' Reagent. In: Modern Synthesis Processes and Reactivity of Fluorinated Compounds. Elsevier, 2017, ISBN 978-0-12-803740-9, S. 125–140, doi:10.1016/b978-0-12-803740-9.00005-6.
- ↑ Jean-Louis Clavel, Bernard Langlois, Eliane Laurent, Nathalie Roidot: Trifluoromethylation of Organic Disulfides with Sodium Trifluoromethanesulfinate under Oxidative Conditions: Synthesis of Trifluoromethyl Thioehters. In: Phosphorus, Sulfur, and Silicon and the Related Elements. Band 59, Nr. 1-4, Mai 1991, S. 169–172, doi:10.1080/10426509108045716.
- ↑ a b Aurélie Claraz, Aurélie Djian, Géraldine Masson: Electrochemical tandem trifluoromethylation of allylamines/formal (3 + 2)-cycloaddition for the rapid access to CF3-containing imidazolines and oxazolidines. In: Organic Chemistry Frontiers. Band 8, Nr. 2, 2021, S. 288–296, doi:10.1039/D0QO01307B.
- ↑ Y. Ji, T. Brueckl, R. D. Baxter, Y. Fujiwara, I. B. Seiple: Innate C-H trifluoromethylation of heterocycles. In: Proceedings of the National Academy of Sciences. Band 108, Nr. 35, 30. August 2011, S. 14411–14415, doi:10.1073/pnas.1109059108, PMID 21844378, PMC 3167544 (freier Volltext).
- ↑ Yingda Ye, Stefan A. Künzi, Melanie S. Sanford: Practical Method for the Cu-Mediated Trifluoromethylation of Arylboronic Acids with CF3 Radicals Derived from NaSO2CF3 and tert-Butyl Hydroperoxide (TBHP). In: Organic Letters. Band 14, Nr. 19, 5. Oktober 2012, S. 4979–4981, doi:10.1021/ol3022726, PMID 22984900, PMC 3513340 (freier Volltext).
- ↑ Marc Presset, Daniel Oehlrich, Frederik Rombouts, Gary A. Molander: Copper-Mediated Radical Trifluoromethylation of Unsaturated Potassium Organotrifluoroborates. In: The Journal of Organic Chemistry. Band 78, Nr. 24, 20. Dezember 2013, S. 12837–12843, doi:10.1021/jo4023233, PMID 24251623, PMC 3886853 (freier Volltext).
- ↑ Zejiang Li, Zili Cui, Zhong-Quan Liu: Copper- and Iron-Catalyzed Decarboxylative Tri- and Difluoromethylation of α,β-Unsaturated Carboxylic Acids with CF3SO2Na and (CF2HSO2)2Zn via a Radical Process. In: Organic Letters. Band 15, Nr. 2, 18. Januar 2013, S. 406–409, doi:10.1021/ol3034059.
- ↑ Bin Yang, Xiu-Hua Xu, Feng-Ling Qing: Copper-Mediated Radical 1,2-Bis(trifluoromethylation) of Alkenes with Sodium Trifluoromethanesulfinate. In: Organic Letters. Band 17, Nr. 8, 17. April 2015, S. 1906–1909, doi:10.1021/acs.orglett.5b00601.








