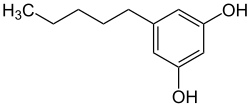
Olivetol
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Olivetol | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C11H16O2 | ||||||||||||||||||
| Kurzbeschreibung |
weißes bis gelblichweißes Pulver[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 180,24 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
162–164 °C (7 hPa)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Olivetol (5-Pentylresorcin) ist ein Naturstoff und das Pentyl-Derivat des Resorcins.
Vorkommen und Gewinnung[Bearbeiten | Quelltext bearbeiten]

Olivetol kommt mit einem Anteil von bis zu 2,6 % in der Blasenflechte (Hypogymnia physodes) vor.[3] Es kommt außerdem als Pheromon in verschiedenen Insektenarten vor.
Chemische Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Da Olivetol durch die phenolischen Hydroxygruppen schwach sauer ist, kann es in basischen Lösungsmitteln gelöst werden.
Verwendung[Bearbeiten | Quelltext bearbeiten]
Olivetol kommt durch die Nutzung des Extraktes der Blasenflechte in verschiedenen Parfüms zum Einsatz.
Durch Kondensation von Pulegon und Olivetol lässt sich Tetrahydrocannabinol synthetisieren.[4] Olivetolsäure (das Carbonsäure-Derivat des Olivetols) tritt in der Biosynthese von Hexahydrocannabinol auf.[5]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Robert Turkington: Chemicals Used for Illegal Purposes. John Wiley & Sons, 2009, ISBN 978-0-470-18780-7, S. 436 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c d Datenblatt Olivetol, 95% bei Sigma-Aldrich, abgerufen am 21. Juni 2015 (PDF).
- ↑ Igor Stojanovic, Niko Radulovic, Tatjana Mitrovic, Slavisa Stamenkovic, Gordana Stojanovic: Volatile constituents of selected Parmeliaceae lichens. In: Journal of the Serbian Chemical Society. Band 76, Nr. 7, 2011, S. 987, doi:10.2298/JSC101004087S.
- ↑ U. Claussen, P. Mummenhoff, F. Korte: Haschisch—XVIII. In: Tetrahedron. Band 24, Nr. 7, Januar 1968, S. 2897, doi:10.1016/s0040-4020(01)98697-1.
- ↑ Raj K. Razdan: Total Synthesis of Natural Products. Hrsg.: John ApSimon. John Wiley & Sons, 1981, ISBN 978-0-470-12967-8, The Total Synthesis of Cannabinoids, S. 185–262, doi:10.1002/9780470129678.ch2 (PDF).
