Pantothenatkinase
| Pantothenatkinase | ||
|---|---|---|
| Bezeichner | ||
| Gen-Name(n) | PANK1, PANK2, PANK3, PANK4 | |
| Enzymklassifikation | ||
| EC, Kategorie | 2.7.1.33, Kinase | |
| Reaktionsart | Phosphorylierung | |
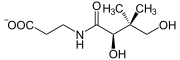
| Substrat | Pantothensäure + ATP | |
| Produkte | Phosphopantothenat + ADP | |
| Vorkommen | ||
| Übergeordnetes Taxon | Lebewesen | |
Pantothenatkinasen sind Enzyme, die Pantothensäure phosphorylieren. Dies ist der erste Reaktionsschritt bei der Biosynthese von Coenzym A in allen Lebewesen. Im Menschen sind vier Paraloge des Enzyms bekannt, die jeweils mehrere Isoformen aufweisen (siehe Tabelle). Mutationen im PANK2-Gen sind verantwortlich für die sehr seltene neurodegenerative Erkrankung Pantothenatkinase-assoziierte Neurodegeneration (PKAN), einer Variante von Neurodegeneration mit Eisenablagerung im Gehirn (NBIA).[1][2]
Katalysiertes Gleichgewicht[Bearbeiten | Quelltext bearbeiten]
(R)-Pantothenat wird zu 4'-(R)-Phosphopantothenat umgewandelt und umgekehrt.
Regulation[Bearbeiten | Quelltext bearbeiten]
Die verschiedenen Paraloge werden durch unterschiedliche Mechanismen reguliert. Während hPanK1 durch Anwesenheit von Acetyl-CoA gehemmt wird, hemmen längerkettige CoA-Derivate das Enzym hPanK3.[3][4]
Humane Enzyme[Bearbeiten | Quelltext bearbeiten]
| Gen (HGNC) | Protein (UniProt) | Anz. Isoformen | Zellkompartiment | Gewebetyp |
|---|---|---|---|---|
| PANK1 | Q8TE04 | 4 | Zytosol | Isoform 1: Hirn, Herz, Nieren, Leber, Skelettmuskeln, Hoden. |
| PANK2 | Q9BZ23 | 3 | Mitochondrien | Ubiquitär |
| PANK3 | Q9H999 | 1 | Zytosol | Leber |
| PANK4 | Q9NVE7 | 1 | Zytosol | Ubiquitär, bes. Muskeln |
Weblinks[Bearbeiten | Quelltext bearbeiten]
- D’Eustachio/reactome.org: Pantothenate is phosphorylated [PANK1;3;4]
- Jassal/reactome.org: Pantothenate is phosphorylated [PANK2]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ UniProt Q9BZ23
- ↑ B. Zhou, S. K. Westaway, B. Levinson, M. A. Johnson, J. Gitschier: A novel pantothenate kinase gene (PANK2) is defective in Hallervorden-Spatz syndrome. In: Nature Genetics. Band 28, Nr. 4, August 2001, ISSN 1061-4036, S. 345–349, doi:10.1038/ng572, PMID 11479594.
- ↑ Zhang YM, Rock CO, Jackowski S: Feedback regulation of murine pantothenate kinase 3 by coenzyme A and coenzyme A thioesters. In: J. Biol. Chem. 280. Jahrgang, Nr. 38, September 2005, S. 32594–601, doi:10.1074/jbc.M506275200, PMID 16040613.
- ↑ Leonardi R, Zhang YM, Lykidis A, Rock CO, Jackowski S: Localization and regulation of mouse pantothenate kinase 2. In: FEBS Lett. 581. Jahrgang, Nr. 24, Oktober 2007, S. 4639–44, doi:10.1016/j.febslet.2007.08.056, PMID 17825826, PMC 2034339 (freier Volltext).