Pyrazole

Pyrazole sind eine Stoffgruppe heterocyclischer chemischer Verbindungen. Sie besitzen einen fünfgliedrigen Ring mit zwei benachbarten Stickstoffatomen und gehörten zu den Azolen. Sie sind isomer zu den Imidazolen und unterscheiden sich von den Isothiazolen und Isoxazolen durch die formale Ersetzung eines Stickstoffatoms durch ein Schwefel- bzw. Sauerstoffatom. 1H-Pyrazole gehören zu den Heteroaromaten, geminal substituierte 3H- oder 4H-Pyrazole sind nicht aromatisch. Durch formale Hydrierung der Doppelbindungen erhält man stufenweise Pyrazoline und Pyrazolidine. Der einfachste Vertreter der Stoffgruppe ist das 1H-Pyrazol.
Darstellung[Bearbeiten | Quelltext bearbeiten]
Die Darstellung von Pyrazolen kann durch eine Kondensationsreaktion aus einem 1,3-Diketon mit Hydrazin erfolgen.
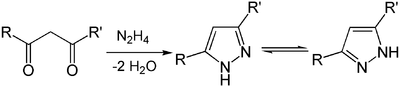
1H-Pyrazole befinden sich oft in einem prototropen Gleichgewicht, so wie es in der Reaktionsgleichung beschrieben ist. Die Bevorzugung einer der beiden Formen wird dabei von den Eigenschaften der Substituenten bestimmt. Bei der Bezeichnung dieser Gemische wird die isomere Stubstituentenstellung in Klammern gesetzt, z. B. 3(5)-Methyl-5(3)-phenyl-1H-pyrazol.
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Pyrazole besitzen aromatischen Charakter. Sie erfüllen die Hückel-Kriterien durch Zuhilfenahme des freien Elektronenpaars des wasserstofftragenden Stickstoffatoms.
Als Aromaten sind an ihnen prinzipiell elektrophile Substitutionen möglich. Inwiefern diese an einer speziellen Verbindung durchführbar sind, ist abhängig von den Substituenten. Wie alle Azole sind auch Pyrazole gegenüber Lewis-Säure nicht stabil, so dass beispielsweise Friedel-Crafts-Acylierungen nicht durchführbar sind.

Durch Deprotonierung des Stickstoffatoms mit einer geeigneten Base und anschließender Umsetzung des entstandenen Anions mit einem Elektrophil können Substituenten am Stickstoffatom eingeführt werden. Als Elektrophile können hierzu beispielsweise Halogenalkane oder Acylhalogenide dienen. Es entstehen N-Alkyle beziehungsweise N-Acyle.

Verwendung von Pyrazolderivaten[Bearbeiten | Quelltext bearbeiten]
Industrie[Bearbeiten | Quelltext bearbeiten]
Derivate der Pyrazols finden in der Industrie unterschiedlichste Verwendung, zum Beispiel als optische Aufheller (Blankophor) für Textilien, Papier, Waschmittel und Kunststoffe. Diverse Farbstoffe enthalten eine Pyrazolkomponente (Pyrazolonblau, der Azofarbstoff Tartrazin, Indazole). Daneben kann man Pyrazolderivate als Komplexbildner und Extraktionsmittel für Metallionen verwenden.
Agrochemie[Bearbeiten | Quelltext bearbeiten]
In der Landwirtschaft nutzt man Pyrazolderivate als Herbizide (Azimsulfuron, Halosulfuron), Akarizide (Fenpyroximat, Tebufenpyrad) und Insektizide (Fipronil). Darüber hinaus haben sie als Nitrifikationshemmer (3,4-Dimethylpyrazolphosphat, DMPP) Bedeutung erlangt, dienen also als nichtauswaschbare Stickstoffquelle.
Medizin[Bearbeiten | Quelltext bearbeiten]
Von großer pharmazeutischer Bedeutung sind die Pyrazolone, eine Gruppe von Analgetika, zu denen das Phenazon, das aus dem Handel genommene Aminophenazon, Propyphenazon, sowie Metamizol gehören. Verwandte Substanzen sind die Antirheumatika Phenylbutazon, Oxyphenbutazon und Sulfinpyrazon. Auch die nichtsteroidalen Antirheumatika (NSAID) Lonazolac, Bufezolac und Trifezolac besitzen als Grundkörper das Pyrazolgerüst, ebenso wie der COX-2-Hemmer Celecoxib. Arzneistoffe mit Pyrazolgrundkörper findet man zusätzlich in unterschiedlichsten Bereichen: Betazol (Histaminagonist), Sulfaphenazol, Sildenafil (PDE-5-Hemmer), Zaleplon, Cortivazol, Granisetron (Antiemetikum), Fomepizol, Stanzolon, Rimonabant. Als Estrogenrezeptorliganden sind außerdem vierfach substituierte Pyrazole im Gespräch.
Literatur[Bearbeiten | Quelltext bearbeiten]
- Houben-Weyl – Methoden der Organischen Chemie, Band E8b, Hetarene III, Teil 2, S. 399, 4. Auflage, Georg Thieme Verlag.
- A. Schmidt, A. Dreger: Recent Advances in the Chemistry of Pyrazoles. Properties, Biological Activities, and Syntheses in Current Organic Chemistry15 (2011) 1423–1463, doi:10.2174/138527211795378263 – Übersichtsartikel zu Eigenschaften, biologische Aktivitäten und Synthesen von Pyrazolen.
- D. T. Davies: Basistexte Chemie: Aromatische Heterocyclen, 1. Auflage, S. 28–34, Wiley-VCH, Weinheim 1995, ISBN 3-527-29289-6.