Quorum Quenching
Als Quorum Quenching (QQ; von engl. to quench, löschen) bezeichnet man die Hemmung der Quorum-Sensing-Erkennung, die durch unterschiedliche Mechanismen ausgelöst werden kann.[1] Bakterien kommunizieren in ihrer Population über kleine Signalmoleküle und regulieren über Quorum Sensing die Bildung pathogener Phänotypen, wie beispielsweise die Bildung infektiöser Schleimschichten und die Synthese von Virulenzfaktoren. Chemische Hemmstoffe, die diese Kommunikation stören, können den Mechanismus des Quorum Quenchings induzieren und dann antimikrobiell wirken.[2] Einige QQ induzierende Verbindungen sind in Pflanzen, Pilzen, Algen und Schwämmen gefunden und inzwischen synthetisch hergestellt worden. Im Gegensatz zu herkömmlichen Antibiotika, die pathogene Mikroorganismen abtöten, verändern diese Wirkstoffe über Quorum Quenching nur den Phänotyp der Bakterien. Die gefürchtete Selektion zur Ausbildung bakterieller Antibiotikaresistenzen findet dabei nicht statt.[3] QQ wird bereits erfolgreich in verschiedenen industriellen Branchen zur Bekämpfung pflanzenpathogener Mikroorganismen eingesetzt.[4]
Quorum Quenching, QQ[Bearbeiten | Quelltext bearbeiten]

Quorum Quenching, kann entweder durch enzymatische Zerstörung der bakteriellen Signalmoleküle oder durch Wechselwirkungen mit spezifisch wirkenden Hemmstoffen stattfinden.[5] Eine Signalstörung in komplexen mikrobiellen Gemeinschaften führt zu Veränderungen der bakteriellen Verhaltensweisen und der Zusammensetzung der Population.[6] Es können unterschiedliche Stoffwechselvorgänge, wie beispielsweise das Infektionsverhalten, die Pathogenität, die Motilität, die Toxinproduktion, die Biofilmbildung und die Populationsgröße von Bakterien beeinflusst und blockiert werden. Viele Bakterien haben die Eigenschaft, zwischen der planktonischen und der sessilen Lebensweise zu wechseln. Besiedeln Mikroorganismen Oberflächen, bilden sie ab einer bestimmten Populationsdichte Biofilme, in denen sie gut geschützt sind, da Biofilme gegenüber Antibiotika Diffusionsbarrieren bilden. Auch gegenüber dem Abwehrsystem des Wirtsorganismus sind sie abgeschirmt. QQ auslösende Wirkstoffe können Biofilme kontrollieren und somit therapeutischen Wirkstoffe der Zukunft sein.

Bakterien vermögen über Quorum Quenching ihre eigenen QS gesteuerten Prozesse zu regulieren, indem sie ihre Autoinduktoren bei Bedarf abbauen und recyceln. So verhindern sie die Anreicherung toxischer Metabolite. Bauen Mikroorganismen in einer gemischten Population über QQ fremde Signalmoleküle ab, verschaffen sie sich gegenüber Konkurrenten einen Vorteil. Sie sind in Bezug auf Nahrungsangebote und Platz begünstigt und erhalten dadurch einen wesentliche Wachstumsvorteile.[7] Da viele pathogene Eigenschaften von Bakterien über QS reguliert werden, kann ein künstlich herbeigeführtes Quorum Quenching durch Verabreichung von Inhibitoren eine Alternative zur konventionellen Antibiotikatherapie oder eine synergistische Therapie darstellen.[8]
Hemmung des Quorum Sensing Systems durch Quorum Quenching[Bearbeiten | Quelltext bearbeiten]
Das QQ-System kann auf verschiedenen Ebenen ausgelöst werden:
- Blockierung der Signalmolekülsynthese durch Inhibitoren oder Substratanaloga,
- enzymatische Spaltung und Modifikation der Signalmoleküle,
- Hemmung der Wechselwirkungen von Signalmolekülen mit Rezeptorproteinen,
- Hemmung und Neutralisierung der freien Signalmoleküle durch freie Antikörper.[9]
Blockierung der Signalmolekülsynthesen durch Inhibitoren[Bearbeiten | Quelltext bearbeiten]
Acylhomoserinlactone (AHL) sind in gramnegativen Bakterien weit verbreitete intrazelluläre Signalmoleküle. Die Biosynthese verläuft ausgehend von einem Hauptaminosäuresubstrat dem S-Adenosylmethionin (SAM) und einem 6-Kohlenstoff-Acyl-Carrier-Protein, die durch die Acyl-Homoserinlactonsynthase zu einem Lactonring mit Acylseitenkette vereint werden.[10] Eine Hemmung der Biosynthese kann zum einen durch fehlerhafte Bildung der Vorläufermoleküle erwirkt oder durch eine Blockierung der AHL-Synthase selbst bedingt werden.

Curcumin, der Hauptbestandteil des Gewürzes Kurkuma, ein Diarylheptanoid, hemmt die Synthese der Signalmoleküle in Pseudomonas aeruginosa, und vermindert dadurch die Pathogenität.[11] Triclosan hemmt nur in subletalen Konzentrationen die SAM-Synthese. Natürliche Fimbrolide, halogenierte Furanone aus der marinen Rotalge Delisea pulchra können die Synthese der AHL-Autoinduktoren in Bakterien, oder auch die Synthese der AI-2 Signalmoleküle in Vibrio stören. Durch konvalente Bindung des Furanons wird das Enzym LuxS-Signalsynthase gehemmt. Zusätzlich blockieren bromierte Furanone in Vibrio die Luziferase-Aktivität, und verringern dadurch die Biolumineszenz.[12] In Escherichia coli und in Bacillus subtilis haben Fimbrolide einen Einfluss auf das Schwarmverhalten, wodurch sie das koordinierte Verhalten von Bakterien innerhalb der Population beeinflussen. In einem Mausmodell konnte gezeigt werden, dass Furanone die Biofilmbildung und damit die Virulenz von Pseudomoas aeruginosa reduzierten und das Überleben der Versuchstiere verlängerten. Inzwischen wurden eine Reihe synthetischer Derivate dieser Verbindungen produziert, die jedoch eine deutlich geringere QQ-Wirkung aufweisen als die natürlichen Verbindungen.[13]
Hemmung der Signalmolekülsynthese durch Substratanaloga[Bearbeiten | Quelltext bearbeiten]
S-Adenosylmethionin und Acyl-Acyl-Carrier-Protein können durch strukturelle Analoga wie beispielsweise S-Adenosyl-L-homocystein, S-Adenosyl-L-cystein, Butyryl-S-Adenosylmethionin und Sinefungin substituiert werden und die Synthese der Signalmoleküle AI-1 blockieren.[14] Das Substratanalogon Sinefungin, ein Nukleosid-Analogon, hemmt bei Streptococcus pneumoniae die Synthese des Signalmoleküls Al-2 und blockiert die S-Adenosylmethionin-abhängigen Methyltransferasen. Dadurch wird die Kolonisation der Erreger und die Bildung pathogener Biofilme in vivo reduziert. Bereits bestehende Biofilme werden jedoch in ihrer Matrixstruktur nicht verändert und abgebaut. Diese bakteriostatische Wirkung auf sich teilende Bakterien konnte auch in andere Bakterienkulturen nachgewiesen werden.[15] Auch in dem QS-Systemen von dem gramnegativen Bakterium Burkholderia glumae, bei dem das Signalmolekül TofI mit dem Rezeptor TofR die Synthese von Toxoflavin, dem Toxin, reguliert, kann der Inhibitor J8-C8 kompetitiv das Acyl-ACP-Carriers-Molekül bei der Synthese hemmen. Die Toxinproduktion von Burkholderia glumae ist dann blockiert. Dieses pflanzenpathogene Bakterium verursacht in Tomaten und Paprikapflanzen Welksymptome und ruft Reiskornfäule hervor.[16]
Enzymatische Spaltung der Signalmoleküle[Bearbeiten | Quelltext bearbeiten]
Signalmoleküle können durch drei verschiedene natürlich vorkommende Enzymarten abgebaut oder chemisch modifiziert werden. Zu diesen Enzymen gehören Amidasen, Lactonasen, Deaminasen, Decarboxylasen und Oxidoreduktasen[17], die in verschiedenen Mikroorganismen, in Archaeen und in Eukaryoten gefunden worden sind. AHL-Lactonasen hydrolysieren in den AHL-Signalmolekülen den Lactonring. Amidasen spalten die Peptidbindung zwischen Acylkette und Lactonring. Oxidoreduktasen oxidieren oder reduzieren die Acylketten.[18] Die Verminderung der spezifischen Ligand-Rezeport Wechselwirkungen führt zu einer Blockierung der QS-Signalübertragung. Einige Vertreter grampositiver Bakterien aus der Gattung Bacillus, die selbst keine Autoinduktoren vom AHL-Typ produzieren, reagieren trotzdem auf die Anwesenheit von externen AHL-Signalmolekülen im Umfeld. Mithilfe der auf dem Gen aiiA codierten β-Lactamasen, einer Hydrolase, können sie im alkalischen Milieu externe AHL-Moleküle von Konkurrenten spalten. So verschaffen sich Bacillusarten Selektionsvorteile innerhalb einer gemischten Bakterienpopulation.[19]
Kompetitive Hemmung der Signal-Rezeptor-Interaktionen[Bearbeiten | Quelltext bearbeiten]

Signalmoleküle des Quorum sensing Systems binden in Mikroorganismen an einen Rezeptor vom LuxR-Typ, der als Signal-Rezeptor-Komplex durch Bindung an den Promotor auf der DNA die QS-gesteuerten Genen aktiviert. Kompetitiv wirkende Substratanaloga können die Bindungen der Signalmoleküle an die Rezeptoren stören, wodurch diese nicht die Genexpression induzieren können. Inzwischen sind eine Reihe von natürlich vorkommenden Substratanaloga aus Pflanzen, Pilzen und Bakterien isoliert und auch chemisch synthetisiert worden. Pflanzliche Flavonoide, wie beispielsweise das Naringenin aus der Grapefruit beeinflussen vor allem die Biofilmbildung.[20] Das Schwarmverhalten von Pseudomonas aeruginosa konnte nachweislich durch die Flavonoide Phloretin[21] und 7,8-Dihydroxyflavon gehemmt werden.[22][23]

In Studien konnte gezeigt werden, dass synthetische AI-2-Analoga wie beispielsweise Isobutyl-DPD oder Phenyl-DPD in Kombination mit Antibiotika QQ-Reaktionen auslösen. Bei den Bakterienstämmen von Escherichia coli und Pseudomonas aeruginosa konnte durch diese Kombinationstherapie eine vollständige Beseitigung bereits vorhandener Biofilme erreicht werden. Der Hemmstoff Savirin, abgeleitet vom Staphylococcus aureus Virulenzinhibitor, kann das QS-System von grampositiven Staphylococcus aureus in vitro blockieren. Der Wirkstoff hemmt sowohl das planktonische Wachstum als auch die Biofilmbildung.[24]

Zimtaldehyde beeinträchtigen die durch den Autoinduktor Al-2 gesteuerten Wechselwirkungen der DNA mit dem Rezeptor LuxR, wodurch die Pathogenität von Vibrio spp deutlich reduziert wird. Da Zimtaldehyde zusätzlich die Matrixproduktion reduzieren, blockieren sie die Biofilmproduktion in Vibrio spp.[25]
Hemmung und Neutralisierung von freien Signalmolekülen durch Antikörper[Bearbeiten | Quelltext bearbeiten]
Signalmoleküle können entweder frei durch die Bakterienmembran diffundieren, aktiv über Transportproteine oder Transportvesikel wie beispielsweise bei P. aeruginosa aufgenommen oder abgegeben werden. Bei Pseudomonas aeruginosa werden die Autoinduktoren 2-Heptyl-3-hydroxy-4-chinolon in Membranvesikel verpackt und transportiert. Durch Inhibitoren kann dieser Vorgang gezielt blockiert werden. Durch den Einsatz spezifische Antikörper können freie Signalmoleküle neutralisiert und abgefangen werden, so dass sie für die QS vermittelnde Reaktionen nicht mehr zur Verfügung stehen. Der spezifische Antikörper AP4-24H11 bindet die Signalmoleküle AIP-4 aus Staphylococcus aureus.[26] Aufgrund dieser Schlüsselrolle, die das QS System bei der Kommunikation und der Kolonisation von Bakterien einnimmt, bilden Hemmstoffe, die das QQ System gerade bei humanpathogen hervorgerufenen bakteriellen Infektionen bedienen, einen weiteren alternativen Therapieansatz neben der Verabreichung von herkömmlichen Antibiotika.[27][28]
QQ vermittelnde Naturstoffe[Bearbeiten | Quelltext bearbeiten]
Eine Reihe von Sekundärmetaboliten aus verschiedenen Pflanzen, aus der Rotalge Delisea pulchra und aus dem Meeresschwamm Agelas oroides vermögen QQ Reaktionen zu induzieren.
| Name der Wirkstoffe | Vorkommen | Strukturformeln der Metabolite | QQ Wirkungen auf verschiedene pathogene Mikroorganismen |
|---|---|---|---|
| Naringenin | Zitruspflanzen, Grapefruit | Naringenin,  |
Pseudomonas aeruginosa und Vibrio harveyi.[29] |
| Knoblauchsulfide und Ajoene | Allium sativum, Echter Knoblauch, | Ajoene,  |
Pseudomonas aeruginosa.[30][31] |
| Iberin, ein Isothiocyanat | Armoracia rusticana, Meerrettich | Grundstruktur des Isothiocyanates, |
Escherichia coli, Pseudomonas aeruginosa, Listeria monocytogenes, Staphylococcus aureus, Enterococcus faecalis, Aggregatibacter actinomycetemcomitans und Candida albicans.[32][33] |
| Curcumin | Curcuma longa, Kurkuma | Curcumin,  |
Aeromonas hydrophila, Pseudomonas aeruginosa.[34] |
| Zimtaldehyde | Zimt | Zimtaldehyd, 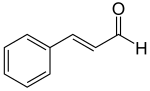 |
Vibrio spp.[35] |
| Muskatnussextrakt, Myristicin | Myristica fragrans | Myristicin,  |
Chromobacterium violaceum, Pseudomonas aeruginosa.[36] |
| Nelkenextrakt, Eugenol | Syzygium aromaticum | Eugenol,  |
Chromobacterium violaceum und Pseudomonas aeruginosa.[37][38] |
| Pflanzenextrakte, alpha-Pinen | Piper nigrum, Piper betle und Gnetum gnemon | alpha-Pinen, 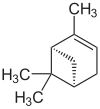 |
Pseudomonas aeruginosa und Chromobacterium violaceum.[39][40] |
| 1,3,7-Trimethylxanthin | Kaffee | 1,3,7-Trimethylxanthin,  |
Pseudomonas aeruginosa, Escherichia coli, Enterobacter aerogenes und Proteus vulgaris.[41] |
| Pyrrol-Alkaloid, Oroidin | Agelas oroides | Oroidin,  |
Pseudomonas aeruginosa, Acinetobacter baumannii und Bordetella bronchispetica.[42] |
| Bromierte Furanone | Delisea pulchra | nichtbromiertes Furanol,  |
Escherichia coli, Pseudomonas aeruginosa und Salmonella enterica Serovar Typhimurium .[43] |
Anwendungsbereiche[Bearbeiten | Quelltext bearbeiten]
QQ wird bereits erfolgreich in verschiedenen industriellen Branchen, wie in der Abwasserkultur, in der Landwirtschaft, in der Umwelt und in der Medizin zur Bekämpfung pathogener oberflächenbesiedelnder Mikroorganismen eingesetzt. Allgemein besteht ein Interesse an der Entwicklung und Verwendung von exogenen Verfahren zur Manipulation und Verhinderung von bakteriell besiedelten Oberflächen. Quorum Quenching Enzyme oder Bakterien, die AHL-Signalmoleküle zerstören, können die Abwasserleistung effektiv verbessern, ohne jedoch das Überleben wichtiger Bakterien zu behindern. Hierbei wird das Membran-Biofouling in Kläranalgen reduziert. In der Aquakultur werden AHL-abbauende Bakterien eingesetzt wie beispielsweise Vertreter der Gattung Flaviramulus, um die Verbreitung von Krankheiten bei Meerestieren einzugrenzen.[44] In der Implantatchirurgie werden verschiedene Implantate mit unterschiedlichen Oberflächeneigenschaften wie Herzklappen, Prothesen, Katheter, u. a. verwendet, die für pathogene Bakterien ideale Oberflächen darstellen und zur Bildung von festsitzenden Biofilmen führen. Die Folgen sind schwer behandelbare Infektionen. Prophylaktische Behandlung der Implantatoberflächen mit QQ wirkenden Enzymen reduzieren die krankheitsverursachende Biofilmbildung wesentlich. In tierischen Infektionsmodelle konnte gezeigt werden, dass verabreichte QQ Enzyme wie Lactonase und Acylasen die Virulenz zahlreicher pathogener Bakterien hemmten. Dazu gehörte auch eine Reduktion bakterieller Oberflächenbesiedlung.[45]
Weblinks[Bearbeiten | Quelltext bearbeiten]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Sudheer Yada, B. Kamalesh, Siddharth Sonwane, Indra Guptha, und R. K. Swetha: Quorum Sensing Inhibition, Relevance to Periodontics. In: Journal of International Oral Health, Band 7, Nummer 1, S. 67-69, Januar 2015, PMC 4336667 (freier Volltext), PMID 25709373, (freier Volltext).
- ↑ Christel Vollstedt und Wolfgang Streit: Sprachstörungen in der Welt der Mikroben Quorum Quenching. In: Biologie in unserer Zeit, Band 51, 2021, doi:10.11576/biuz-4250, (freier Volltext).
- ↑ Rakesh Sikdar und Mikael Elias: Quorum quenching enzymes and their effects on virulence, biofilm and microbiomes: a review of recent advances. In: Expert Review of Anti-Infective Therapy, Band 18, Nummer 12, S. 1221-1233, Dezember 2020, doi:10.1080/14787210.2020.1794815, (freier Volltext).
- ↑ Jinhui Huang, Yahui Shi, Guangming Zeng, Yanling Gu, Guiqiu Chen, Lixiu Shi, Yi Hu, Bi Tang und Jianxin Zhou: Acyl-homoserine lactone-based quorum sensing and quorum quenching hold promise to determine the performance of biological wastewater treatments: an overview. In: Chemosphäre, Band 157, S. 137–151, August 2016, doi:10.1016/j.chemosphere.2016.05.032.
- ↑ Sudheer Yada, B. Kamalesh, Siddharth Sonwane, Indra Guptha, and R. K. Swetha: Quorum Sensing Inhibition, Relevance to Periodontics. In: Journal of International Oral Health, Band 7, Nummer 1, S. 67-69, Januar 2015, PMC 4336667 (freier Volltext), PMID 25709373, (freier Volltext).
- ↑ Rakesh Sikdar und Mikael Elias. Quorum quenching enzymes and their effects on virulence, biofilm and microbiomes: a review of recent advances. In: Expert Review of Anti-Infective Therapy, Band 18, Nummer 12, S. 1221-1233, Dezember 2020, doi:10.1080/14787210.2020.1794815, PMID 32749905, (freier Volltext).
- ↑ Zahid Ur. Rehman und TorOve Leiknes: Quorum-Quenching Bacteria Isolated From Red Sea Sediments Reduce Biofilm Formation by Pseudomonas aeruginosa. In: Frontiers in Microbiology, Band 9, S. 1354, 17. Juli 2018, doi:10.3389/fmicb.2018.01354, (freier Volltext).
- ↑ Christel Vollstedt und Wolfgang Streit: Sprachstörungen in der Welt der Mikroben, Quorum Quenching. In: Biologie in unserer Zeit, Band 51, Nummer 2, 2021, doi:10.11576/biuz-4250, (freier Volltext).
- ↑ Christel Vollstedt und Wolfgang Streit: Sprachstörungen in der Welt der Mikroben, Quorum Quenching. In: Biologie in unserer Zeit, Band 51, Nummer 2, 2021, doi:10.11576/biuz-4250, (freier Volltext).
- ↑ Matthew R. Parsek, Dale L. Val, Brian L. Hanzelka, John E. Cronan, Jr. und E. P. Greenberg: Acyl homoserine-lactone quorum-sensing signal generation. In: Proceedings of the National Academy of Sciences of the United States of America, Band 96, Nummer 8, S. 4360–4365, 13. April 1999, doi:10.1073/pnas.96.8.4360, (freier Volltext).
- ↑ Andréia Bergamo Estrela und Wolf-Rainer Abraham: Combining Biofilm-Controlling Compounds and Antibiotics as a Promising New Way to Control Biofilm Infections. In: Pharmaceuticals, Band 3, Nummer 5, S. 1374-1393, 2010, doi:10.3390/ph3051374, (freier Volltext).
- ↑ Weining Zhao, Nicola Lorenz, Prof. Dr. Kirsten Jung und Prof. Dr. Stephan A. Sieber: Fimbrolide Natural Products Disrupt Bioluminescence of Vibrio By Targeting Autoinducer Biosynthesis and Luciferase Activity. In: Angewandte Chemie International Edition, Band 55, Nummer 3, S. 1187-91, Januar 2016, doi:10.1002/anie.201508052.
- ↑ Dr. Sina Rütschlin und Dr. Thomas Böttcher: Inhibitors of Bacterial Swarming Behavior. In: Chemistry, Band 26, Nummer 5, S. 964–979, 20. Januar 2020, doi:10.1002/chem.201901961, (freier Volltext).
- ↑ Sudheer Yada, B. Kamalesh, Siddharth Sonwane, Indra Guptha, and R. K .Swetha: Quorum Sensing Inhibition, Relevance to Periodontics. In: Journal of International Oral Health, Band 7, Nummer 1, Januar 2015, S. 67–69; PMC 4336667 (freier Volltext), PMID 25709373.
- ↑ Mukesh Kumar Yadav, Seok-Won Park, Sung-Won Chae, und Jae-Jun Song: Sinefungin, a Natural Nucleoside Analogue of S-Adenosylmethionine, Inhibits Streptococcus pneumoniae Biofilm Growth. In: BioMed Research International, S. 156987, 2014, doi:10.1155/2014/156987, (freier Volltext).
- ↑ Christel Vollstedt und Wolfgang Streit. Sprachstörungen in der Welt der Mikroben, Quorum Quenching. In: Biologie in unserer Zeit, Band 51, Nummer 2, 2021, doi:10.11576/biuz-4250, (freier Volltext).
- ↑ Fang Chen, Yuxin Gao, Xiaoyi Chen, Zhimin Yu und Xianzhen Li: Quorum quenching enzymes and their application in degrading signal molecules to block quorum sensing-dependent infection. In: International Journal of Molecular Sciences, Band 14, Nummer 9, S. 17477-500, 2013, doi:10.3390/ijms140917477, (freier Volltext).
- ↑ Yi-Han Lin 1, Jin-Ling Xu, Jiangyong Hu, Lian-Hui Wang, Say Leong Ong, Jared Renton Leadbetter und Lian-Hui Zhang: Acyl-homoserine lactone acylase from Ralstonia strain XJ12B represents a novel and potent class of quorum-quenching enzymes. In: Molecular Microbiology, Band 47, Artikel 3, S. 849–60, Februar 2003, doi:10.1046/j.1365-2958.2003.03351.x, (freier Volltext).
- ↑ Y.H. Dong, J.L. Xu, X.Z. Li und L.H. Zhang: AiiA, an enzyme that inactivates the acylhomoserine lactone quorum-sensing signal and attenuates the virulence of Erwinia carotovora. In: Proceedings of the National Academy of Sciences of the United States of America, Band 97, Nummer 7, S. 3526-31, 28. März 2000, doi:10.1073/pnas.97.7.3526.
- ↑ Fohad Mabood Husain, Kahkashan Perveen, Faizan Abul Qais, Iqbal Ahmad, Ahmed H. Alfarhan, und Mohamed A. El-Sheikh: Naringin inhibits the biofilms of metallo-β-lactamases (MβLs) producing Pseudomonas species isolated from camel meat. In: Saudi Journal of Biological Sciences, Band 1, S. 333–341, Januar 2021, doi:10.1016/j.sjbs.2020.10.009, (freier Volltext).
- ↑ C.L.Gardel und J.J. Mekalanos: Alterations in Vibrio cholerae motility phenotypes correlate with changes in virulence factor expression.In: Infection and Immunity, Band 64, Nummer 6, S. 2246-55, Juni 1996, doi:10.1128/iai.64.6.2246-2255.1996, (freier Volltext).
- ↑ Andreia Bergamo Estrela und Wolf-Rainer Abraham: Combining biofilm-controlling compounds and antibiotics as a promising new way to control biofilm infections. In: Pharmaceuticals, Band 3, Nummer 5, Mai 2010, S. 1374–93, doi:10.3390/ph3051374, (freier Volltext).
- ↑ Sara Hernando-Amado, Manuel Alcalde-Rico, Teresa Gil-Gil, José R. Valverde und José L. Martínez: Naringenin Inhibition of the Pseudomonas aeruginosa Quorum Sensing Response Is Based on Its Time-Dependent Competition with N-(3-Oxo-dodecanoyl)-l-homoserine Lactone for LasR Binding. In: Frontiers in Molecular Biosciences Biosci, Band 7, Nummer 25, 2020, doi:10.3389/fmolb.2020.00025, (freier Volltext).
- ↑ Christel Vollstedt und Wolfgang Streit: Sprachstörungen in der Welt der Mikroben, Quorum Quenching. In: Biologie in unserer Zeit, Band 51, Nummer 2, 2021, doi:10.11576/biuz-4250, (freier Volltext).
- ↑ Gilles Brackmann, Shari Celen, Ulrik Hillaert, Serge van Calenbergh, Paul Kos, Louis Maes, Hans J. Nelis und Tom Coenye: Structure-activity relationship of cinnamaldehyde analogs as inhibitors of AI-2 based quorum sensing and their effect on virulence of Vibrio spp. In: Public Library of Science One, Band 6, Nummer 1, e16084, 13. Januar 2011, doi:10.1371/journal.pone.0016084, (freier Volltext).
- ↑ Christel Vollstedt und Wolfgang Streit: Sprachstörungen in der Welt der Mirkoben, Quorum Quenching. In: Biologie in unserer Zeit, Band 51, Nummer 2, 2021, doi:10.11576/biuz-4250, (freier Volltext).
- ↑ Kok-Gan Chan, Yi-Chia Liu and Chien-Yi. Chang: Inhibiting N-acyl-homoserine lactone synthesis and quenching Pseudomonas quinolone quorum sensing to attenuate virulence. In: Frontiers in Microbiology. Band 6, S. 1173, 19. Oktober 2015, doi:10.3389/fmicb.2015.01173, (freier Volltext).
- ↑ Yi-Hu Dong, Jin-Ling Xu, Xian-Zhen Li und Lian-Hui Zhang: AiiA, an enzyme that inactivates the acylhomoserine lactone quorum-sensing signal and attenuates the virulence of Erwinia carotovora. In: Proceedings of the National Academy of Sciences. Band 97, S. 3526–3531, doi:10.1073/pnas.97.7.3526.
- ↑ Andréia Bergamo Estrela und Wolf-Rainer Abraham: Combining Biofilm-Controlling Compounds and Antibiotics as a Promising New Way to Control Biofilm Infections. In: Pharmaceuticals, Band 3, Nummer 5, Mai 2010, S. 1374–93, doi:10.3390/ph3051374, (freier Volltext).
- ↑ Andréia Bergamo Estrela und Wolf-Rainer Abraham: Combining biofilm-controlling compounds and antibiotics as a promising new way to control biofilm infections. In: Pharmaceuticals, Band 3, Nummer 5, Mai 2010, S. 1374–93, doi:10.3390/ph3051374, (freier Volltext).
- ↑ Tim H. Jakobsen, Anders N. Warming, Rebecca M. Vejborg, Joana A. Moscoso, Marc Stegger, Frederik Lorenzen, Morten Rybtke, Jens B. Andersen, Rico Petersen, Paal Skytt Andersen, Thomas E. Nielsen, Tim Tolker-Nielsen, Alain Filloux, Hanne Ingmer und Michael Givskov: A broad range quorum sensing inhibitor working through sRNA inhibition. In: Scientific Reports, Band 7, Nummer 9857, August 2017, doi:10.1038/s41598-017-09886-8, (freier Volltext).
- ↑ Prof. Dr. Sigrun Chrubasik-Hausmann: Kapuzinerkresse plus Meerrettichwurzel. (freier Volltext), [www.uniklinik-freiburg.de/fileadmin/mediapool/08_institute/rechtsmedizin/pdf/Kapuzinerkresse_Meerrettichwurzel.pdf] (PDF).
- ↑ Tim Holm Jakobsen, Steinn Kristinn Bragason, Richard Kerry Phipps, Louise Dahl Christensen, Maria van Gennip, Morten Alhede, Mette Skindersoe, Thomas Ostenfeld Larsen, Niels Høiby, Thomas Bjarnsholt und Michael Givskov: Food as a Source for Quorum Sensing Inhibitors: Iberin from Horseradish Revealed as a Quorum Sensing Inhibitor of Pseudomonas aeruginosa. In: Applied and Environmental Microbiology, Januar 2012, doi:10.1128/AEM.05992-11, (freier Volltext).
- ↑ Hadi Tanhay Mangoudehi, Hojjatolah Zamani, Seyyedeh Shirin Shahangian und Laleh Mirzanejad: Effect of curcumin on the expression of ahyI/R quorum sensing genes and some associated phenotypes in pathogenic Aeromonas hydrophila fish isolates. In: World J Microbiol Biotechnol, Band 36, Nummer 5, April 2020, doi:10.1007/s11274-020-02846-x.
- ↑ Gilles Brackmann, Shari Celen, Ulrik Hillaert, Serge van Calenbergh, Paul Kos, Louis Maes, Hans J. Nelis und Tom Coenye: Structure-activity relationship of cinnamaldehyde analogs as inhibitors of AI-2 based quorum sensing and their effect on virulence of Vibrio spp. In: Public Library of Science One, Band 6, Nummer 1, 13. Januar 2011, S. e16084, doi:10.1371/journal.pone.0016084, ( freier Volltext).
- ↑ Estrela AB und Abraham WR: Combining biofilm-controlling compounds and antibiotics as a promising new way to control biofilm infections. In: Pharmaceuticals, Band 3, Mai 2010, S. 20131374–93, doi:10.3390/ph3051374, (freier Volltext).
- ↑ Krishnan T, Yin WF und Chan KG: Inhibition of quorum sensing-controlled virulence factor production in Pseudomonas aeruginosa PAO1 by ayurveda spice clove (Syzygium aromaticum) bud extract. In: Sensors (Basel), Band 12, Nummer 4, 2012, S. 4016–30, doi:10.3390/s120404016, (freier Volltext).
- ↑ Prasanth Rathinam und Pragasam Viswanathan: Anti-virulence potential of eugenol-rich fraction of Syzygium aromaticum against multidrug resistant uropathogens isolated from catheterized patients. In: Avicenna J Phytomed, Band 8, Nummer 5, September 2018, S. 416–431, PMC6190244, PMID|30345229, (freier Volltext).
- ↑ Tan LY, Yin WF und Chan KG: Piper nigrum, Piper betle and Gnetum gnemon – Natural food sources with anti-quorum sensing properties. In: Sensors (Basel), Band 13, Nummer 3, 2013, S. 3975–85, doi:10.3390/s130303975, (freier Volltext).
- ↑ Katarina Simunović, Orhan Sahin, Jasna Kovac, Zhangqi Shen, Anja Klančnik, Qijing Zhang und Sonja Smole Možina: (-)-α-Pinene reduces quorum sensing and Campylobacter jejuni colonization in broiler chickens. In: PLOS ONE, Band 15, Nummer 4, 20 April 2020, S. 0230423, doi:10.1371/journal.pone.0230423, (freier Volltext).
- ↑ Norizan SN, Yin WF und Chan KG: Caffeine as a potential quorum sensing inhibitor. In: Sensors (Basel), Band 13, Nummer 4, 2013, S. 5117–29, doi:10.3390/s130405117, (freier Volltext).
- ↑ Dimitri Kowalerchik, Ravindra Pal Singh, Pnina Schlesinger, Aseel Mahajni, Sigal Schefer, Micha Fridmann, Micha Illan und Schmuel Carmeli: Bromopyrrole Alkaloids of the Sponge Agelas oroides Collected Near the Israeli Mediterranean Coastline. In: Journal of Natural Products, Band 83, Nummer 2, Februar 2020, S. 374–84, doi:10.1021/acs.jnatprod.9b00863.
- ↑ Andréia Bergamo Estrela und Wolf-Rainer Abraham. Combining Biofilm-Controlling Compounds and Antibiotics as a Promising New Way to Control Biofilm Infections. In: Pharmaceuticals, Band 3, Nummer 5, 2010, S. 1374-1393, doi:10.3390/ph3051374, (freier Volltext).
- ↑ Jinhui Huang, Yahui Shi, Guangming Zeng, Yanling Gu, Guiqiu Chen, Lixiu Shi, Yi Hu, Bi Tang und Jianxin Zhou: Acyl-homoserine lactone-based quorum sensing and quorum quenching hold promise to determine the performance of biological wastewater treatments: an overview. In: Chemosphäre, Band 157, S. 137–151, August 2016, doi:10.1016/j.chemosphere.2016.05.032.
- ↑ Rakesh Sikdar und Mikael Elias: Quorum quenching enzymes and their effects on virulence, biofilm and microbiomes: a review of recent advances. In: Expert Review of Anti-infective Therapy Aims, Band 18, Nummer 12, S. 1221–1233, Dezember 2020, doi:10.1080/14787210.2020.1794815,(freier Volltext).