Rosenthal-Reagenz


Bei dem Rosenthal-Reagenz (auch Rosenthal-Komplex) handelt es sich um einen Metallocen-bis(trimethylsilyl)acetylen-Komplex, wobei als Zentralatom des Metallocenfragments Cp2M Zirconium (Cp2Zr) oder Titan (Cp2Ti) verwendet werden können. Zusätzlich kommen häufig weitere Liganden (z. B. Pyridin) zum Einsatz. Mit Zirconium als Zentralatom und Pyridin als Ligand bildet sich ein dunkelvioletter bis schwarzer Feststoff, der sich gegenüber Sauerstoff und Feuchtigkeit empfindlich zeigt und bei 125–126 °C unter Zersetzung schmilzt.[1][2] Bei der Verwendung von Titan wird ein goldglänzender Feststoff mit einem Schmelzpunkt von 81–82 °C erhalten.[3] Mithilfe des Reagenzes können die ansonsten instabilen Metallocen-Fragmente unter milden Bedingungen generiert und für weitere Reaktionen verfügbar gemacht werden.[1][4]
Das Reagenz ist nach dem deutschen Chemiker Uwe Rosenthal (* 1950) benannt, der es 1995 mit seinen Mitarbeitern erstmals synthetisierte.[2]
Herstellung[Bearbeiten | Quelltext bearbeiten]
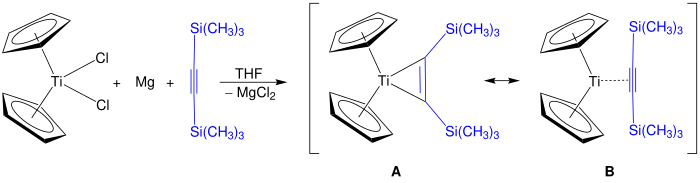
Das Rosenthal-Reagenz lässt sich durch die Reduktion von Titanocen- oder Zirconocendichlorid mit Magnesium in Gegenwart von Bis(trimethylsilyl)acetylen in THF synthetisieren. Das für Titanocen dargestellte Reaktionsprodukt weist die Resonanzstrukturen A und B auf. Bei Verwendung von Zirconium als Zentralatom werden zusätzliche Liganden, z. B. Pyridin, zur Stabilisierung des Reagenzes benötigt.[5]
Anwendung und Reaktionen[Bearbeiten | Quelltext bearbeiten]
Ein Anwendungsschwerpunkt ist die Synthese von anspruchsvollen organischen Strukturen wie Makrocyclen und Heterometallacyclen, welche mithilfe des Rosenthal-Reagenzes selektiv und mit hohen Ausbeuten gewonnen werden können.[6][7]
Das Rosenthal-Reagenz wird heutzutage häufig anstelle des Negishi-Reagenzes (1-Buten)zirconocen zur Generierung von Zirconocenfragmenten eingesetzt, da es einige entscheidende Vorteile aufweist. Im Gegensatz zum Negishi-Reagenz ist das Rosenthal-Reagenz bei Raumtemperatur stabil und in inerter Umgebung lagerbar. Dies erlaubt eine erheblich präzisere Kontrolle über die Stöchiometrie der Reaktionen, insbesondere da sich das instabile Negishi-Reagenz nicht quantitativ bilden lässt.[7] Es lassen sich somit stöchiometrische und katalytische Reaktionen durchführen, welche durch die verwendeten Liganden, Metalle und Substrat-Substituenten beeinflusst werden. Während Titan-Komplexe dissoziativ reagieren, bevorzugen Zirconium-Komplexe die assoziative Reaktionsweise.[6] Eine Kombination dieser organometallischen Komplexe mit verschiedenen Substraten (z. B. Carbonylverbindungen, Acetylene, Imine, Azole etc.) führt häufig zu neuen Bindungstypen und Reaktivitäten.[4][8] Von besonderem Interesse sind hierbei neuartige C-C-Kupplungsreaktionen, welche die Bildung von Heterometallacyclen ermöglichen.[6] Als Nebenprodukte von Kupplungsreaktionen werden beim Rosenthal-Reagenz meistens Pyridin und Bis(trimethylsilyl)acetylen erhalten. Diese sind löslich und flüchtig, was die Trennung vom Reaktionsprodukt erheblich erleichtert.[7]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b Julian Linshoeft: Rosenthal’s Zirconocene. In: Synlett. Band 25, Nr. 18, 2014, S. 2671–2672, doi:10.1055/s-0034-1379317.
- ↑ a b Uwe Rosenthal, Andreas Ohff, Wolfgang Baumann, Annegret Tillack, Helmar Görls: Struktur, Eigenschaften und NMR-spektroskopische Charakterisierung von Cp2Zr(Pyridin)(Me3SiC≡CSiMe3). In: Zeitschrift für anorganische und allgemeine Chemie. Band 621, Nr. 1, Januar 1995, S. 77–83, doi:10.1002/zaac.19956210114.
- ↑ Uwe Rosenthal, Vladimir V. Burlakov: Organometallic Chemistry of Titanocene and Zirconocene Complexes with Bis(trimethylsilyl)acetylene as the Basis for Applications in Organic Synthesis. In: Titanium and Zirconium in Organic Synthesis. Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, FRG, ISBN 3-527-30428-2, S. 355–389, doi:10.1002/3527600671.ch10.
- ↑ a b A. Ohff, S. Pulst, C. Lefeber, N. Peulecke, P. Arndt: Unusual Reactions of Titanocene- and Zirconocene-Generating Complexes. In: Synlett. Band 1996, Nr. 2, 1996, S. 111–118, doi:10.1055/s-1996-5338.
- ↑ Uwe Rosenthal, Vladimir V. Burlakov, Perdita Arndt, Wolfgang Baumann, Anke Spannenberg: The Titanocene Complex of Bis(trimethylsilyl)acetylene: Synthesis, Structure, and Chemistry†. In: Organometallics. Band 22, Nr. 5, März 2003, S. 884–900, doi:10.1021/om0208570.
- ↑ a b c U. Rosenthal: Reaktionen von Gruppe-4-Metallocen-Komplexen des Bis(trimethylsilyl)acetylens mit Nitrilen und Isonitrilen. In: Angewandte Chemie. 23. August 2018, doi:10.1002/ange.201805157.
- ↑ a b c Jonathan R. Nitschke, Stefan Zürcher, T. Don Tilley: New Zirconocene-Coupling Route to Large, Functionalized Macrocycles. In: Journal of the American Chemical Society. Band 122, Nr. 42, Oktober 2000, S. 10345–10352, doi:10.1021/ja0020310.
- ↑ Uwe Rosenthal, Paul-Michael Pellny, Frank G. Kirchbauer, Vladimir V. Burlakov: What Do Titano- and Zirconocenes Do with Diynes and Polyynes? In: Accounts of Chemical Research. Band 33, Nr. 2, Februar 2000, S. 119–129, doi:10.1021/ar9900109.