Rucaparib
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
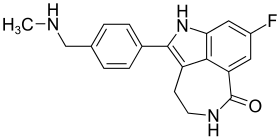
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Rucaparib | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C19H18FN3O | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkmechanismus |
PARP-Inhibitoren | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 323,37 g·mol−1 | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Rucaparib ist ein antitumoraler Wirkstoff aus der Gruppe der PARP-Inhibitoren, der als Rubraca (Hersteller: Clovis Oncology) zur oralen Behandlung von bestimmten Formen des fortgeschrittenen, rezidivierten Ovarialkarzinoms (Eierstockkrebs), Eileiterkarzinoms oder Peritonealkarzinoms (Bauchfellkrebs) eingesetzt wird.
Anwendungsgebiete[Bearbeiten | Quelltext bearbeiten]
Rucaparib wurde im Dezember 2016 von der US-amerikanischen Zulassungsbehörde (FDA) zur Behandlung des rezidivierten Ovarialkarzinoms mit BRCA-Mutationen (Mutationen in den Genen BRCA1 oder BRCA2) für die USA zugelassen.[2] Im Mai 2018 erteilte die Europäische Kommission eine Zulassung in der Europäischen Union (EU) als Monotherapie zur Behandlung von erwachsenen Patientinnen mit platinsensitivem, rezidiviertem oder progressivem high-grade Ovarial-, Eileiter- oder Peritonealkarzinom mit BRCA-Mutationen (Keimbahn und/oder somatisch), die mit zwei oder mehr vorherigen platinbasierten Chemotherapielinien behandelt wurden und keine weitere platinhaltige Chemotherapie tolerieren.[3][4] Damit war Rucaparib der erste PARP-Inhibitor, der für eine Rezidivbehandlung von BRCA-mutierten Ovarialkarzinomen in der EU zugelassen wurde.[3] Nach einem Rote-Hand-Brief im August 2022 soll Rucaparib jedoch in dieser Indikation nicht mehr eingesetzt werden, da Studienergebnisse zeigten, dass das Gesamtüberleben bei Behandlung mit Rucaparib gegenüber Chemotherapie verkürzt ist.[5]
Im Januar 2019 erfolgte in der EU eine Zulassungserweiterung als Monotherapie zur Erhaltungstherapie von erwachsenen Patientinnen mit platinsensitivem, rezidiviertem oder progressivem high-grade Ovarial-, Eileiter- oder primärem Peritonealkarzinom, die nach platinbasierter Chemotherapie in Remission sind (vollständig oder partiell).[3][4] Diese Indikation ist unabhängig vom Vorliegen einer BRCA-Mutation und besteht mit Stand August 2022 weiterhin. Auf dem deutschen Markt ist Rucaparib unter dem Handelsnamen Rubraca seit März 2019 erhältlich.
Die European Society for Medical Oncology (ESMO) und European Society of Gynaecological Oncology (ESGO) haben im April 2018 Rucaparib in die Behandlungsempfehlungen des Ovarialkarzinoms sowohl als Erhaltungstherapie nach einem Ansprechen auf eine platinbasierte Chemotherapie ab der Zweitlinie sowie ab der dritten Therapielinie auch als Monotherapie bei Patientinnen mit BRCA-Mutationen aufgenommen.[6]
Rote-Hand-Briefe[Bearbeiten | Quelltext bearbeiten]
Im Mai und August 2022 wurde durch zwei Rote-Hand-Briefe mitgeteilt, dass in der klinischen Studie CO-338-043 (ARIEL4)[7] bei Behandlung mit Rucaparib in Monotherapie ein kürzeres Gesamtüberleben festgestellt wurde als unter einer Chemotherapie. Nach Prüfung aller verfügbaren Daten durch die Europäische Arzneimittel-Agentur (EMA) wurde entschieden, die Indikation von Rucaparib einzuschränken. Rucaparib sollte nicht mehr als Monotherapie zur Behandlung von erwachsenen Patientinnen mit platinsensitivem, rezidiviertem oder progressivem high-grade epithelialem Ovarial-, Eileiter- oder primärem Peritonealkarzinom mit BRCA-Mutationen (in der Keimbahn und/oder somatisch) eingesetzt werden, die zuvor mindestens zwei platinhaltige Chemotherapielinien erhalten haben und keine weitere platinhaltige Chemotherapie tolerieren. Laufende Behandlungen bei diesen Patientinnen sollten neu überdacht und die Patientinnen über die neuesten Daten und Empfehlungen informiert werden. Die Indikationen von Rucaparib zur Erhaltungstherapie von Patientinnen, die nach platinbasierter Chemotherapie in Remission sind, ist davon nicht betroffen und bleibt weiterhin bestehen.[8][5]
Art und Dauer der Anwendung[Bearbeiten | Quelltext bearbeiten]
Rucaparib-Tabletten gibt es in drei Dosisstärken: 300 mg, 250 mg und 200 mg. Die Anfangsdosis gemäß Zulassung beträgt 600 mg zweimal täglich, was einer Gesamttagesdosis von 1200 mg entspricht.[3]
Unerwünschte Wirkungen[Bearbeiten | Quelltext bearbeiten]
Die häufigsten unerwünschten Nebenwirkungen, die bei Rucaparib behandelten Patientinnen auftraten, waren Übelkeit, Müdigkeit/Asthenie, Erbrechen, Anämie, Schmerzen des Abdomens, Dysgeusie, erhöhte ALT-Werte, erhöhte AST-Werte, verminderter Appetit, Diarrhoe, Thrombozytopenie und erhöhte Kreatininwerte. Die Nebenwirkungen waren mehrheitlich leicht bis mittelschwer (1. oder 2. Grades). Zu den häufigsten höhergradigen Nebenwirkungen (Grad 3 oder höher) zählten Anämie (23 %), erhöhte ALT-Werte (10 %), Müdigkeit/Asthenie (10 %), Neutropenie (8 %), Thrombozytopenie (6 %) und Übelkeit (5 %). Mittelschwere bis schwere Nebenwirkungen (d. h. 3. oder 4. Grades nach CTCAE), wie Neutropenie, Anämie und Thrombozytopenie können mit Dosisunterbrechungen und/oder Dosisreduzierungen gemindert werden. Nebenwirkungen, die zum dauerhaften Absetzen führten, traten bei 10 % der Patientinnen auf.[3]
Wirkmechanismus[Bearbeiten | Quelltext bearbeiten]
Rucaparib blockiert die Aktivität von Poly(ADP-Ribose)-Polymerasen (PARP) (PARP-1, -2 und -3), die zur Reparatur von DNA-Einzelstrangbrüchen benötigt werden. In Krebszellen, die Defekte in der Reparatur von DNA-Doppelstrangbrüchen aufweisen, wie z. B. vermittelt durch BRCA-Mutationen oder Defekten in anderen DNA-Reparaturwegen, führt die Hemmung von PARP zur Anhäufung von DNA-Doppelstrangbrüchen, wodurch die Zellen in den programmierten Zelltod (Apoptose) getrieben werden (synthetische Letalität).[9] Der Wirkmechanismus wurde unter anderem von der britischen Onkologin Nicola Curtin untersucht.[10]
Klinische Studien[Bearbeiten | Quelltext bearbeiten]
Die Zulassung von Rucaparib als Rezidiv-Erhaltungstherapie erfolgte auf Basis der randomisierten doppelblinden Phase-III-Studie ARIEL3[11], in der die Wirksamkeit und Sicherheit im Vergleich zu Placebo bei 564 Patientinnen mit Ovarialkarzinom untersucht wurde, die ein komplettes oder partielles Ansprechen auf mindestens zwei vorherige platinbasierte Chemotherapien zeigten. ARIEL3 erreichte sowohl den primären Endpunkt einer Verlängerung des vom Prüfarzt festgestellten progressionsfreien Überlebens (PFS) im Vergleich zu Placebo (Median 10,8 vs. 5,4 Monate) als auch den sekundären Endpunkt einer Verlängerung des PFS durch eine unabhängige radiologische Überprüfung (independent radiological review, IRR; Median 13,7 vs. 5,4 Monate) jeweils unabhängig vom BRCA-Status. In Bezug auf das Gesamtüberleben zeigten sich in dieser Auswertung keine Unterschiede zwischen Rucaparib und Placebo (jeweils 22 % der Patienten waren verstorben), wobei die Ergebnisse zu diesem Zeitpunkt noch nicht als aussagekräftig betrachtet wurden.[12] Die finale Analysie des Gesamtüberlebens der Studie ARIEL3 ist mit Stand August 2022 noch nicht erfolgt.[11]
Die Zulassung von Rucaparib als Rezidivmonotherapie ab der Drittlinie bei Patientinnen mit fortgeschrittenem epithelialem Ovarial-, Eileiter- oder primärem Peritonealkarzinom mit BRCA-Mutationen basiert auf den Ergebnissen der beiden einarmigen Phase-II-Studien ARIEL2 und Studie 10.[13]
Weitere Studien laufen, um die Wirksamkeit von Rucaparib beim Ovarialkarzinom und in anderen Indikationen zu untersuchen, unter anderem beim Prostatakarzinom[14][15]. Im Januar 2020 wurde für Rucaparib eine Zulassungserweiterung beim BRCA-mutierten, rezidivierten kastrationsresistenten Prostatakarzinom bei der FDA eingereicht und erhielt eine „priority review designation“.[16]
Pharmakokinetische Angaben[Bearbeiten | Quelltext bearbeiten]
Die mittlere absolute orale Bioverfügbarkeit nach einer Einzeldosis von 12 – 120 mg betrug 36 %, maximale Plasmaspiegel traten im Mittel nach 1,9 Stunden auf. Die Metabolisierung erfolgt über verschiedene Enzyme des Cytochrom-P450-Systems; vorwiegend CYP2D6, in geringerem Ausmaß CYP1A2 und CYP3A4. Die mittlere Halbwertszeit von Rucaparib liegt bei 25,9 Stunden.[3]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von 8-fluoro-2-{4-[(methylamino)methyl]phenyl}-1,3,4,5-tetrahydro-6H-pyrrolo[4,3,2-ef][2]benzazepin-6-one im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 12. Juli 2020.
- ↑ Resources for Information, Approved Drugs: Rucaparib, Mitteilung der FDA vom 19. Dezember 2016, abgerufen am 7. Mai 2020.
- ↑ a b c d e f Europäische Arzneimittelagentur: Zusammenfassung der Merkmale des Arzneimittels: Rubraca Filmtabletten, Stand Mai 2019 (PDF).
- ↑ a b Rubraca (Rucaparib) – Übersicht über Rubraca und warum es in der EU zugelassen ist. (PDF; 0,1 MB) Europäische Arzneimittel-Agentur (EMA), 18. Dezember 2019, abgerufen am 31. August 2022.
- ↑ a b Clovis Oncology: Rucaparib (Rubraca®): Einschränkung der Indikation. Arzneimittelkommission der deutschen Ärzteschaft, 8. August 2022, abgerufen am 9. August 2022.
- ↑ N. Colombo, et al.: ESMO–ESGO consensus conference recommendations on ovarian cancer: pathology and molecular biology, early and advanced stages, borderline tumours and recurrent disease. In: International Journal of Gynecological Cancer. Band 29 (2019), S. 728–760, doi:10.1136/ijgc-2019-000308.
- ↑ NCT02855944 ARIEL4: A Study of Rucaparib Versus Chemotherapy BRCA Mutant Ovarian, Fallopian Tube, or Primary Peritoneal Cancer Patients ClinicalTrials.gov
- ↑ Clovis Oncology: Rucaparib (Rubraca®): Zwischendaten zur klinischen Studie CO-338-043 (ARIEL4) zeigen kürzeres Gesamtüberleben als unter der Standardtherapie. Arzneimittelkommission der deutschen Ärzteschaft, 6. Mai 2022, abgerufen am 9. Mai 2022.
- ↑ LE Dockery, CC Gunderson, KN Moore: Rucaparib: the past, present, and future of a newly approved PARP inhibitor for ovarian cancer. In: OncoTargets and Therapy. Volume 10, Juni 2017, S. 3029–3037, doi:10.2147/ott.s114714.
- ↑ Full-length Q&A with Professor Nicola Curtin. 31. Juli 2023 (englisch).
- ↑ a b NCT01968213 A Study of Rucaparib as Switch Maintenance Following Platinum-Based Chemotherapy in Patients With Platinum-Sensitive, High-Grade Serous or Endometrioid Epithelial Ovarian, Primary Peritoneal or Fallopian Tube Cancer (ARIEL3) ClinicalTrials.gov
- ↑ Coleman RL, et al.: Rucaparib maintenance treatment for recurrent ovarian carcinoma after response to platinum therapy (ARIEL3): a randomised, double-blind, placebo-controlled, phase 3 trial. In: Lancet. Band 390, Nr. 10106, 28. Oktober 2017, S. 1949–1961, doi:10.1016/S0140-6736(17)32440-6, PMID 28916367, PMC 5901715 (freier Volltext).
- ↑ Oza AM, et al. Gynecol Oncol. 2017;147(2):267-275. doi: 10.1016/j.ygyno.2017.08.022.
- ↑ NCT02952534 A Study of Rucaparib in Patients With Metastatic Castration-resistant Prostate Cancer and Homologous Recombination Gene Deficiency (TRITON2) ClinicalTrials.gov
- ↑ NCT02975934 A Study of Rucaparib Versus Physician's Choice of Therapy in Patients With Metastatic Castration-resistant Prostate Cancer and Homologous Recombination Gene Deficiency (TRITON3) ClinicalTrials.gov
- ↑ Clovis Oncology’s Rubraca (rucaparib) granted FDA priority review for advanced prostate cancer [news release]. Boulder, Colorado: Clovis Oncology; January 15, 2020.