Selentetrachlorid
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| _ Se4+ _ Cl− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Selentetrachlorid | |||||||||||||||
| Andere Namen |
Selen(IV)-chlorid | |||||||||||||||
| Verhältnisformel | SeCl4 | |||||||||||||||
| Kurzbeschreibung |
gelblicher Feststoff mit stechendem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 220,77 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[2] | |||||||||||||||
| Dichte |
2,6 g·cm−3 (25 °C)[2] | |||||||||||||||
| Schmelzpunkt |
305 °C (unter Druck)[3] | |||||||||||||||
| Sublimationspunkt | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Brechungsindex |
1,807 (20 °C)[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Selentetrachlorid ist eine anorganische chemische Verbindung des Selens aus der Gruppe der Chloride.
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Selentetrachlorid kann durch Reaktion von Selen mit Chlor gewonnen werden.[3]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Selentetrachlorid ist ein farbloser[7] bis gelblicher feuchtigkeitsempfindlicher Feststoff mit stechendem Geruch, der sich mit Wasser und an feuchter Luft zu Seleniger Säure und Salzsäure zersetzt.[1][8]
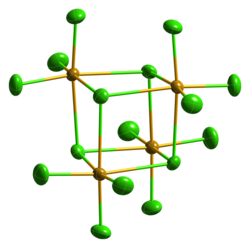
Beim Erhitzen sublimiert Selentetrachlorid.[1] Im geschlossenen Rohr schmilzt es bei etwa 305 °C zu einer dunkelroten Flüssigkeit.[3] Es kristallisiert kubisch in der Raumgruppe P43n (Raumgruppen-Nr. 218) mit dem Gitterparameter a = 16,433 Å.[9] Auch eine metastabile, monokline Struktur ist bekannt (Raumgruppe C2/c (Nr. 15), a = 16,548, b = 9,81, c = 15,029 Å, β = 116,95°).[10] In konzentrierter Salzsäure bildet SeCl4 mit Alkalichloriden Hexachloroselenate(IV), wie z. B. das gelbe Caesiumhexachloroselenat(IV) Cs2[SeCl6].[11]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e Datenblatt Selenium(IV) chloride bei Alfa Aesar, abgerufen am 24. November 2013 (Seite nicht mehr abrufbar).
- ↑ a b c d Datenblatt Selenium tetrachloride bei Sigma-Aldrich, abgerufen am 25. Mai 2017 (PDF).
- ↑ a b c Georg Brauer, unter Mitarbeit von Marianne Baudler u. a. (Hrsg.): Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band 1. Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 417.
- ↑ Henry G. Nowak and John F. Suttle: Selenium(IV) chloride. In: Therald Moeller (Hrsg.): Inorganic Syntheses. Band 5. McGraw-Hill, Inc., 1957, S. 125–127 (englisch).
- ↑ Jean d’Ans, Ellen Lax, Roger Blachnik: Taschenbuch für Chemiker und Physiker. Springer DE, 1998, ISBN 3-642-58842-5, S. 720 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag Selenverbindungen mit Ausnahme von Cadmiumsulfoselenid, soweit in diesem Anhang nicht gesondert aufgeführt im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 10. Januar 2023. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 621.
- ↑ Wilhelm Ostwald: Grundlinien der anorganischen Chemie. BoD – Books on Demand, 1922, ISBN 3-86195-686-1, S. 351 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ R. Kniep, L. Korte, D. Mootz: Crystal structure of the stable modification of SeCl4. In: Zeitschrift für Naturforschung, Teil B, 36, 1981, S. 1660–1662, doi:10.1515/znb-1981-1231.
- ↑ P. Born, D. Mootz, R. Kniep, M. Hein, B. Krebs: Phase relations in the system Se-SeCl4 and the crystal structure of a metastable modification of SeCl4. In: Zeitschrift für Naturforschung, Teil B, 36, 1981, S. 1516–1519, doi:10.1515/znb-1981-1206.
- ↑ Synthetic Methods of Organometallic and Inorganic Chemistry, Volume 4, 1997: Volume 4: Sulfur, Selenium and Tellurium, W. A. Herrmann und Christian Erich Zybill, Georg Thieme Verlag, 2014, ISBN 3131794410




