Spiropentan
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Spiropentan | ||||||||||||
| Andere Namen |
Spiro[2.2]pentan | ||||||||||||
| Summenformel | C5H8 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 68,12 g·mol−1 | ||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||
| Dichte |
D420 = 0,7266 g·cm−3[1] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Siedepunkt | |||||||||||||
| Brechungsindex |
1,4120 (20 °C)[2] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||
Der alicyclische Kohlenwasserstoff Spiropentan ist der einfachste Vertreter der Spiroverbindungen. Er enthält fünf Kohlenstoffatome, welche zwei Cyclopropanringe bilden, die über ein gemeinsames Kohlenstoffatom verknüpft sind. Nach den Nomenklaturregeln für Spiroverbindungen lautet der systematische Name Spiro[2.2]pentan. Es kann jedoch keine konstitutionsisomeren Spiropentane geben, daher ist der Name ohne Klammern und Ziffern eindeutig.
Herstellung[Bearbeiten | Quelltext bearbeiten]
Nachdem Gustavson (1887) aus 1,3-Dibrompropan durch Reaktion mit Zinkstaub in wasserhaltigem Ethanol Cyclopropan erhalten hatte, wandte er diese Methode auf 2,2-Bis(brommethyl)-1,3-dibrompropan (siehe Formelschema) an. Dieses Tetrabromid war leicht aus Pentaerythrit herzustellen. Er erhielt so einen Kohlenwasserstoff mit der Summenformel C5H8, den er zunächst als Vinyltrimethylen ansah.[5] Fecht äußerte die Vermutung, dass es sich um Spiropentan handeln müsse, ein Konstitutionsisomer des Vinylcyclopropans.[6]
Einen Beweis für die Struktur des Kohlenwasserstoffs konnte man in der Tatsache sehen, dass er auch aus einer Cyclopropanverbindung – 1,1-Bis(brommethyl)-cyclopropan – (siehe Formelschema) erhalten werden konnte.[1]
Gustavsons formal einfache Synthese wurde mehrfach wiederholt. Es stellte sich heraus, dass das so hergestellte Spiropentan nicht rein war, sondern mehr oder weniger große Anteile an anderen Kohlenwasserstoffen enthielt.[7] Jahrzehnte später wurde das Herstellungsverfahren verbessert; der Spirokohlenwasserstoff wurde durch Rektifikation von den Nebenprodukten (2-Methyl-1-buten, 1,1-Dimethylcyclopropan, Methylencyclobutan) abgetrennt und die Reinheit durch Gaschromatographie überprüft.[3]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Physikalische Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Eine Strukturbestimmung mittels Elektronenbeugung ergab zwei unterschiedliche C–C-Bindungslängen; die Bindungen zum quartären Kohlenstoffatom („Spiro-C-Atom“) sind kürzer (146,9 pm) als die Bindungen zwischen den Methylen-Gruppen (CH2–CH2, 151,9 pm). Der C–C–C-Winkel am Spiro-C-Atom beträgt 62,2°, ist also größer als beim Cyclopropan.[8]
Chemische Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Beim Erhitzen von mit Deuteriumatomen markiertem Spiropentan wurde – wie beim Cyclopropan – eine Topomerisierung beobachtet, auch Stereomutation genannt: cis-1,2-Dideuteriospiropentan bildet in einer Gleichgewichtsreaktion trans-1,2-Dideuteriospiropentan.[9]
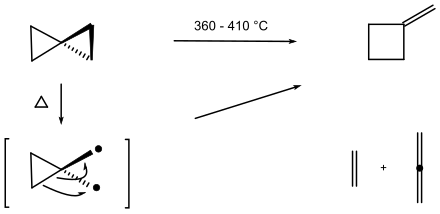
Schon Gustavson (1896) berichtete, dass der Kohlenwasserstoff beim Erhitzen auf 200 °C in andere Kohlenwasserstoffe umgewandelt wird. Eine Thermolyse in der Gasphase bei 360 bis 410 °C ergab, dass eine Ringerweiterung zum konstitutionsisomeren Kohlenwasserstoff Methylencyclobutan erfolgt; daneben entstehen die Spaltprodukte Ethen und Allen.[10] Vermutlich wird die längere – schwächere – Bindung im Spiropentan bevorzugt gespalten; ein Diradikal kann als Zwischenstufe angenommen werden.[9]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c N. Zelinsky, Über das Spirocyclan, seine Synthese und sein Verhalten bei der Reduktionskatalyse. In: Berichte der Deutschen Chemischen Gesellschaft, Bd. 46 (1913), S. 160–172. doi:10.1002/cber.19130460128
- ↑ a b David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-462.
- ↑ a b D. E. Applequist, G. F. Fanta, B. W. Henrikson, Chemistry of Spiropentane. I. An Improved Synthesis of Spiropentane. In: Journal of Organic Chemistry, Bd. 23, Nr. 11, (1958) 1715–1716.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ G. Gustavson, Über Vinyltrimethylen. In: Journal für praktische Chemie. Band 54, (1896), S. 97–104.
- ↑ H.Fecht, Über Spirocyclane. In: Berichte der Deutschen Chemischen Gesellschaft, Bd. 40 (1907), S. 3883–3891. doi:10.1002/cber.190704003194
- ↑ Literatur bei D. Wendisch, Carbocyclische Dreiringverbindungen, S. 37. In: Eugen Müller (Hrsg.), Methoden der Organischen Chemie (Houbel-Weyl), Bd. IV/3, Thieme, Stuttgart, 1971.
- ↑ G. Dallinga, R. K. van der Draai, L. H. Toneman, Recueil des Travaux Chimiques des Pays-Bas 87, 897 (1968).
- ↑ a b J. J. Gajewski, L. T. Burka, Journal of the American Chemical Society 94, Nr. 25, 8857 (1972).
- ↑ M. C. Flowers, H. M. Frey, Journal of the Chemical Society, 1961, 5550.