Tetraboran
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
| Allgemeines | |||||||
| Name | Tetraboran | ||||||
| Andere Namen |
| ||||||
| Summenformel | B4H10 | ||||||
| Kurzbeschreibung |
unangenehm riechendes Gas[1] | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 53,32 g·mol−1 | ||||||
| Aggregatzustand |
gasförmig[2] | ||||||
| Schmelzpunkt | |||||||
| Siedepunkt |
17,6 °C[2] | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Tetraboran, genauer Tetraboran(10), ist eine anorganische chemische Verbindung aus der Gruppe der Borane.
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Tetraboran(10) entsteht durch Zersetzung von Diboran(6) bei Temperaturen oberhalb von 50 °C, wobei auch Wasserstoff und höhere Boranen (Pentaboran, Hexaboran, Decaboran und andere) entstehen.
Die Bildung von Tetraboran(10) ausgehend von Diboran(6) lässt sich durch geeignete Reaktionsbedingungen optimieren. So entsteht Tetraboran(10) in einer Ausbeute von bis zu 95 % Ausbeute bei der Thermolyse von Diboran(6) bei einem Druck von 170 kPa zwischen zwei konzentrischen Glasrohren, von denen das innere auf 120 °C geheizt und das äußere auf −78 °C gekühlt wird („Heiß-Kalt-Reaktor“).[4]
Die Umsetzung einer Mischung von MBH4 und MB3H8 (M+ = NEt4+ oder PPh4+) mit CH3I ermöglicht die Herstellung von Tetraboran(10) in hohen Ausbeuten und ohne großen apparativen Aufwand.[5]
Von eher historischem Interesse ist die Bildung von Tetraboran(10) bei der Umsetzung von Magnesiumborid mit Säuren[6] (vgl. Abschnitt Geschichte unten) und die Herstellung von Tetraboran(10) durch Enthalogenierung von Ioddiboran mit Natrium in der Form von Na-Amalgam.[2][7]
Strukturelle Eigenschaften[Bearbeiten | Quelltext bearbeiten]

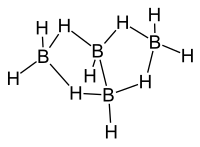
Tetraboran(10) ist ein Boran aus der Gruppe der arachno-Borane mit der allgemeinen Summenformel BnHn+6. Die Struktur von Tetraboran(10) leitet sich nach der Wade-Regel von dem geschlossenen Polyeder mit n+2 Ecken, d. h. dem Polyeder mit 4 + 2 = 6 Ecken, dem Oktaeder ab. Hierbei besetzen die vier Boratome von Tetraboran(10) vier der sechs Ecken des Oktaeders.
Das B4H10-Molekül besitzt C2v-Symmetrie. Zwei BH-Einheiten sind über eine zentrale BB-2-Elektronen-2-Zentren-Bindung miteinander verknüpft. Die beiden anderen Boratome liegen als BH2-Einheiten vor und sind jeweils über zwei verbrückende Wasserstoffatome über BHB-2-Elektronen-3-Zentren-Bimdungen mit beiden Boratomen der zentralen H-B-B-H-Einheit verbunden. Die Boratome der beiden BH2-Einheiten liegen mit den Boratomen der zentralen H-B-B-H-Einheit nicht in einer Ebene, sondern schließen mit diesen einen Winkel von ca. 120° ein (vgl. die Quellen im nächsten Abschnitt). Es liegt eine sogenannte Schmetterlings-Struktur vor.
Die Struktur von Tetraboran(10) wurde im festen Zustand durch Röntgenstrukturanalyse an einem Einkristall[8] und in der Gasphase durch Elektronenbeugung[9][10][11] bestimmt.
Neben der oben beschriebenen Schmetterlings-Struktur mit C2v-Symmetrie wurde durch theoretische Berechnungen vorhergesagt, dass das Konstitutions-isomere aber bisher nicht isolierte Bisdiboran ähnliche Stabilität besitzen sollte. Hierbei wären zwei Diborane(6) unter Ersatz von jeweils einem endständigen Wasserstoffatom über eine BB-Bindung im Sinne von H2B(H2)BH–BH(H2)BH2 miteinander verknüpft.[12][13]
Chemische Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Tetraboran(10) ist ein unangenehm riechendes Gas. Reines Tetraboran(10) entzündet sich nicht an Luft, wird jedoch durch Wasser zu Borsäure und Wasserstoff hydrolysiert. Es zersetzt sich bei Raumtemperatur in einigen Stunden (bei höheren Temperaturen rascher) zu anderen Boranen.[1] Bis 100 °C zerfällt es hauptsächlich in Wasserstoff, Diboran(6) und Pentaboran(9), bei höherer Temperatur in Wasserstoff, Pentaboran(9), Hexaboran und borreiche Hydride.[2] Es wird von Brom und Chlor weit langsamer angegriffen als Diboran.[14]
Tetraboran(10) ist eine schwache Säure und lässt sich mit sehr starken Basen wie NaH, KH oder LiCH3[15] zum entsprechenden, bei Raumtemperatur instabilen Mono-Anion B4H9– deprotonieren.[4]
Geschichte[Bearbeiten | Quelltext bearbeiten]
Tetraboran(10) ist das erste Boran, welches in Substanz isoliert wurde. Es wurde durch Destillation als eines der Produkte der Umsetzung von Magnesiumborid mit Salzsäure gewonnen.[6]
Literatur[Bearbeiten | Quelltext bearbeiten]
- Nils Wiberg: Hollemann – Wiberg, Lehrbuch der Anorganischen Chemie, Walter de Gruyter Berlin, New York 2007, 102. Auflage, S. 1075–1077, ISBN 978-3-11-017770-1
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b Eintrag zu Tetraboran(10). In: Römpp Online. Georg Thieme Verlag, abgerufen am 5. September 2017.
- ↑ a b c d e Karl A. Hofmann: Anorganische Chemie. Springer-Verlag, 2013, ISBN 978-3-663-14240-9, S. 400 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b Nils Wiberg: Hollemann - Wiberg, Lehrbuch der Anorganischen Chemie, Walter de Gruyter Berlin, New York 2007, 102. Auflage, S. 1075–1077, ISBN 978-3-11-017770-1
- ↑ Brellochs, B., Binder, H.: Neue Synthesewege zu B4H10 und B5H9/New Synthetic Routes to B4H10 and B5H9, Zeitschrift für Naturforschung B, 1988, 43(6), S. 648–653; doi:10.1515/znb-1988-0602
- ↑ a b STOCK, Alfred; MASSENEZ, Carl Borwasserstoffe, Berichte der deutschen chemischen Gesellschaft, 1912, 45(3), S. 3539–3568; doi:10.1002/cber.191204503113
- ↑ Stock, A., Pohland, E.: Borwasserstoffe, X.: B2H5J. Synthese des B4H10, Berichte der deutschen chemischen Gesellschaft (A and B Series), 1926, 59(9), S. 2223–2226
- ↑ Nordman, C. E., Lipscomb, W. N.: The molecular structure of B4H10, Journal of the American Chemical Society, 1953, 75(16), S. 4116–4117; doi:10.1021/ja01112a543
- ↑ Jones, M. E., Hedberg, K., Schomaker, V.: On the structure of Tetraborane, Journal of the American Chemical Society, 1953, 75(16), S. 4116
- ↑ Dain, C. J., Downs, A. J., Laurenson, G. S., Rankin, D. W.: The molecular structure of tetraborane (10) in the gas phase as determined by a joint analysis of electron-diffraction and microwave data, Journal of the Chemical Society, Dalton Transactions, 1981, (2), 472–477; doi:10.1039/DT9810000472
- ↑ Brain, P. T., Morrison, C. A., Parsons, S., Rankin, D. W.: Tetraborane (10), B4H10: structures in gaseous and crystalline phases, Journal of the Chemical Society, Dalton Transactions, 1996, (24), S. 4589–4596; doi:10.1039/DT9960004589
- ↑ Morris-Sherwood, B. J., Hall, M. B.: Theoretical study of the structure of tetraborane (10), Chemical Physics Letters, 1981, 84(1), S. 194–196
- ↑ McKee, M. L.: Can the bis (diboranyl) structure of tetraborane (10) be observed?, Inorganic Chemistry, 1986, 25(19), S. 3545–3547; doi:10.1021/ic00239a050
- ↑ Karl A. Hofmann: Lehrbuch der anorganischen Experimentalchemie. Springer-Verlag, 2013, ISBN 978-3-663-04369-0, S. 383 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Pinsky, M. L., Bond, A. C.: Deprotonation of tetraborane (10), Inorganic Chemistry, 1973, 12(3), S. 605–607; doi:10.1021/ic50121a024


![{\displaystyle \mathrm {B_{4}H_{10}\ +\ MH\longrightarrow \ M[B_{4}H_{9}]\ +\ H_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/e9975ecc937e0996d6b2e4b4e038e3babecd16d4)