Thian-4-on
Zur Navigation springen
Zur Suche springen
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Thian-4-on | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C5H8OS | ||||||||||||||||||
| Kurzbeschreibung |
hellgelber Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 116,18 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Thian-4-on ist eine chemische Verbindung, die in einigen Naturstoffsynthesen verwendet wurde, wie etwa von Robert B. Woodward zur Synthese von Erythromycin.[3]
Synthese[Bearbeiten | Quelltext bearbeiten]
Ein klassischer Ansatz zur Synthese von Thian-4-on ist die Dieckmann-Kondensation von Dimethyl-3,3'-thiodipropionat zu 3-Carboxymethyl-thian-4-on und anschließender Verseifung und Decarboxylierung:[4][5]
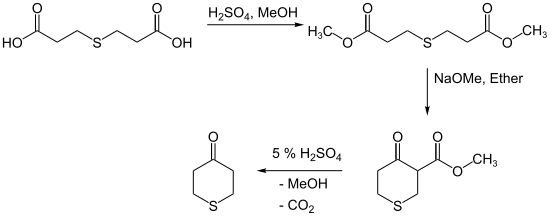
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Thian-4-on ist ein hellgelber Feststoff.[1] Im gasförmigen Zustand hat sich das Molekül in der Sesselkonformation als am stabilsten erwiesen. Die Bindungslängen wurden mit ra(CO) = 1,223(5) Å, ra(C-S) = 1,804(3) Å, ra(C-C)av = 1,527(3) Å, ra(C-H) = 1,116(6) Å ermittelt.[6]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f Datenblatt Tetrahydro-4H-thiopyran-4-one, 99% bei Alfa Aesar, abgerufen am 23. Juli 2021 (Seite nicht mehr abrufbar).
- ↑ Richard Montgomery Stephenson: Handbook of the Thermodynamics of Organic Compounds. Springer Science & Business Media, 2012, ISBN 978-94-009-3173-2 (books.google.com).
- ↑ Woodward, R. B.; Logusch, E.; Nambiar, K. P.; Sakan, K.; Ward, D. E.; Au-Yueng, B. W.; Balaram, P.; Browne, L. J.: Card, P. J.; Chen, C. H. et al.: Asymmetric total synthesis of erythromycin. 1. Synthesis of an erythronolide A secoacid derivative via asymmetric induction. In: JACS. Band 103, Nr. 11, 1981, S. 3210–3213, doi:10.1021/ja00401a049.
- ↑ Haru Matsuyama, Yasuyuki Miyazawa, Yuji Takei und Michio Kobayashi: A Regioselective Synthesis of Cyclopentenones from 4-Thianone. In: J. Org. Chem. Band 52, Nr. 9, 1986, S. 1706, doi:10.1021/jo00385a011.
- ↑ Edward A. Fehnel und Marvin Carmack: Studies in the Thiapyran Series. The Preparation, Properties and Reactions of 1,4-Thiapyrone-1-dioxide. In: JACS. Band 70, Nr. 5, 1948, S. 1813–1817, doi:10.1021/ja01185a048.
- ↑ R. Seip, H. M. Seip, Z. Smith: Structure of gaseous 4-thiacyclohexanone studied by electron diffraction. In: Journal of Molecular Structure. Band 32, Nr. 2, 1976, S. 279–284, doi:10.1016/0022-2860(76)85006-5.
