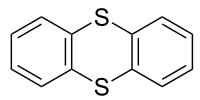
Thianthren
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Thianthren | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C12H8S2 | |||||||||||||||
| Kurzbeschreibung |
beiger Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 216,32 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
364–366 °C[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Thianthren ist eine Schwefel enthaltende heterocyclische Verbindung. Es ist das Schwefel-Analogon von Dibenzodioxin. Im Gegensatz zu diesem ist Thianthren nicht planar, sondern weist zwischen den Ebenen der beiden Benzolring-Teilstrukturen einen Winkel von 128° auf.[2][3][4]

Thianthren ist im Gegensatz zum Sauerstoff-Analogon Dibenzodioxin nicht planar
Darstellung[Bearbeiten | Quelltext bearbeiten]
Thianthren kann durch eine Reaktion von Dischwefeldichlorid mit Benzol in Gegenwart von Aluminiumchlorid dargestellt werden.[5]
Geschichte[Bearbeiten | Quelltext bearbeiten]
Die Synthese von Thianthren gelang erstmals John Stenhouse.[6] Thianthren reagiert mit Schwefelsäure zu einem roten Produkt. R. Wizinger publizierte die Struktur des für die Farbe verantwortlichen Kations im Jahr 1929.[7] Vier Studien zur Struktur des Thianthren-Radikalkations wurden unabhängig voneinander publiziert.[8]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f Datenblatt Thianthren bei Sigma-Aldrich, abgerufen am 23. Januar 2011 (PDF).
- ↑ S. Hosoya: Molecular shapes of thianthrene and related heterocyclic compounds. In: Acta Crystallographica. 16. Jahrgang, 1963, S. 310–312, doi:10.1107/S0365110X63000797.
- ↑ K. L. Gallaher, S. H. Bauer: Structure and inversion potential of thianthren. In: Journal of the Chemical Society, Faraday Transactions 2. 71. Jahrgang, 1975, S. 1173–1182, doi:10.1039/F29757101173.
- ↑ M. J. Aroney, R. J. W. Le Fèvre, J. D. Saxby: 92. Molecular polarisability. The apparent conformations of thianthren and of three of its oxides as solutes in benzene. In: Journal of the Chemical Society (Resumed). 1965, S. 571–575, doi:10.1039/JR9650000571.
- ↑ Patent Process for the manufacture of thianthrene, Nummer 3997560, 14. Dezember 1976.
- ↑ J. Stenhouse: Ueber die Producte der trockenen Destillation der sulfobenzolsauren Salze. In: Annalen der Chemie und Pharmacie. 149. Jahrgang, 1869, S. 247–255, doi:10.1002/jlac.18691490216.
- ↑ W. Dilthey: Versammlungsberichte Bonner Chemische Gesellschaft, in: Angewandte Chemie, Vol. 42, Nr. 24, S. 668–670, 15. Juni 1929; doi:10.1002/ange.19290422405.
- ↑ Gareth R. Eaton: Foundations of Modern EPR. World Scientific, 1998, ISBN 978-9-810-23295-5, S. 202 (eingeschränkte Vorschau in der Google-Buchsuche).
