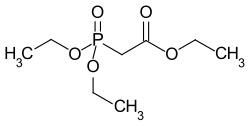
Triethylphosphonoacetat
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Triethylphosphonoacetat | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C8H17O5P | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 224,19 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[2] | ||||||||||||||||||
| Dichte |
1,125 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
260–262 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
mischbar mit Wasser.[2] | ||||||||||||||||||
| Brechungsindex |
1,4310 (20 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Triethylphosphonoacetat ist eine chemische Verbindung aus der Gruppe der Acetate und Phosphonate.
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Triethylphosphonoacetat kann durch eine Arbusow-Reaktion von Triethylphosphit und Ethylchloracetat gewonnen werden.[3]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Triethylphosphonoacetat ist eine farblose[1] bis hellgelbe Flüssigkeit mit starkem Geruch, die mischbar mit Wasser ist.[2]
Verwendung[Bearbeiten | Quelltext bearbeiten]
Triethylphosphonoacetat dient als Reagenz bei Horner-Wadsworth-Emmons-Reaktionen, Reaktionen vom Tsuji-Trost-Typ, intramolekularen Zyklisierungen und Isomerisierungen vom Heck-Typ und intramolekularen Arine-en-Reaktionen. Bei der Horner-Wadsworth-Emmons-Reaktion wird es als Reagenz zur Herstellung chiraler 2-Methylcyclopropancarbonsäure aus (S)-Propylenoxid verwendet.[2][4]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e Datenblatt Triethyl phosphonoacetate, purum, ≥97.0% (GC) bei Sigma-Aldrich, abgerufen am 16. September 2020 (PDF).
- ↑ a b c d e f g h i j k Datenblatt Triethyl phosphonoacetate, 98+% bei Alfa Aesar, abgerufen am 16. September 2020 (Seite nicht mehr abrufbar).
- ↑ Patent CN106397481: Synthesis method of triethyl phosphonoacetate. Angemeldet am 30. August 2016, veröffentlicht am 15. Februar 2017, Anmelder: Jiangxi Sunway Chemical Co. Ltd., Erfinder: Tang Enjiang.
- ↑ Michael W. Rathke, Michael Nowak: The Horner-Wadsworth-Emmons modification of the Wittig reaction using triethylamine and lithium or magnesium salts. In: The Journal of Organic Chemistry. Band 50, Nr. 15, 1985, S. 2624–2626, doi:10.1021/jo00215a004.
