1-Tetralon
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 1-Tetralon | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C10H10O | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 146,19 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt |
2–7 °C[2] | |||||||||||||||
| Siedepunkt | ||||||||||||||||
| Dampfdruck |
2,7 Pa (20 °C)[1] | |||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser[1], löslich in Diethylether,[4] Benzol,[5] Toluol und p-Xylol[6] | |||||||||||||||
| Brechungsindex | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
1-Tetralon ist ein bicyclischer aromatischer Kohlenwasserstoff mit α-ständiger Ketogruppe (Benzocycloalkanon), das auch als benzoanelliertes Cyclohexanon aufgefasst werden kann und als Ausgangsstoff für Agro- und Pharmawirkstoffe Verwendung findet.
Vorkommen und Darstellung[Bearbeiten | Quelltext bearbeiten]
Der Grundkörper des α-Tetralons kommt auch in Naturstoffen vor, wie z. B. in dem so genannten Aristelegone A (4,7-Dimethyl-6-methoxy-1-tetralon) aus der in der traditionellen chinesischen Medizin verwendeten Familie der Aristolochiaceae.[8]
1-Tetralon durch Oxidation von Tetralin[Bearbeiten | Quelltext bearbeiten]
Wie bereits 1933 von Heinrich Hock beschrieben, neigt Tetralin zur Autoxidation und bildet mit Luftsauerstoff allmählich das 1-Hydroperoxid.[9] Die schwermetallionenkatalysierte Luftoxidation von Tetralin mit Cr3+[10] oder Cu2+ in flüssiger Phase führt über das Hydroperoxid zu einem Gemisch aus der Zwischenstufe 1-Tetralol und dem Endprodukt 1-Tetralon.[11]

Wegen der praktisch identischen Siedepunkte der Hauptkomponente 1-Tetralon (255–257 °C) und der Nebenkomponente 1-Tetralol (255 °C)[12] wird letztere durch chemische Umsetzung entfernt.[5]
1-Tetralon durch Friedel-Crafts-Reaktion von 4-Phenylbuttersäure[Bearbeiten | Quelltext bearbeiten]
Die Ausgangsverbindung 4-Phenylbuttersäure (dessen Natriumsalz Natriumphenylbutyrat zur Behandlung der Hyperammonämie eingesetzt wird) ist aus 3-Benzoylpropionsäure über katalytische Hydrierung an einem Palladium-Kontakt mit einer Ausbeute von 96 % zugänglich.[4] 3-Benzoylpropionsäure[13] selbst ist durch eine nach Robert Downs Haworth benannte Haworth-Reaktion (einer Variante der Friedel-Crafts-Reaktion) aus Benzol und Bernsteinsäureanhydrid in 77- bis 82%iger Ausbeute erhältlich.
Ein neueres Patent[14] beansprucht die Synthese von 4-Phenylbuttersäure über eine Friedel-Crafts-Acylierung von Benzol und γ-Butyrolacton mit Aluminiumchlorid bei 60 °C und Aufarbeitung mit verdünnter Natronlauge und anschließendem Ansäuern in 94%iger Rohausbeute und 81 % Reinstausbeute.
Die intramolekulare Cyclisierung der 4-Phenylbuttersäure zu 1-Tetralon in 75- bis 86%iger Ausbeute kann durch Erhitzen mit Polyphosphorsäure herbeigeführt werden.[4]

Die säurekatalysierte Cyclisierung kann auch mit Methansulfonsäure durchgeführt werden.[15] Dieser Reaktionsweg mit Ausbeuten zwischen 23 und 80 % ist als Arbeitsvorschrift für den Chemieunterricht beschrieben worden.[16]
Auch durch Zugabe katalytischer Mengen an starken Lewis-Säuren, wie z. B. dem relativ einfach zugänglichen Bismut (III)-bis(trifluormethansulfonyl)amid Bi(NTf2)3 [17] kann 4-Phenylbuttersäure bei 180 °C quantitativ in 1-Tetralon überführt werden.[6]
1-Tetralon durch Friedel-Crafts-Reaktion von 4-Phenylbuttersäurechlorid[Bearbeiten | Quelltext bearbeiten]
Deutlich kürzere Reaktionszeiten als die Friedel-Crafts-Acylierung mit 4-Phenylbuttersäure ermöglicht die Verwendung des Säurechlorids (durch Umsetzung mit Phosphorpentachlorid) mit überstöchiometrischen Mengen von Zinn(IV)-chlorid SnCl4, wobei nach der Methode B der Vorschrift Gesamtausbeuten von 85 bis 91 % erzielt werden.[5]

4-Phenylbuttersäurechloride mit elektronenabgebenden Gruppen (Elektronendonatoren) können bereits in dem starke Wasserstoffbrückenbindungen ausbildenden Lösungsmittel Hexafluorisopropanol HFIP unter milden Reaktionsbedingungen in Ausbeuten größer 90 % zu 1-Tetralonen cyclisiert werden.[18]
1-Tetralon durch Friedel-Crafts-Reaktion von γ-Butyrolacton[Bearbeiten | Quelltext bearbeiten]
Die Acylierung von Benzol mit γ-Butyrolacton mit überschüssigem Aluminiumchlorid liefert nach Methode A[5] α-Tetralon in Ausbeuten von 91 bis 96 %.

Nachteilig bei vielen Varianten der Friedel-Crafts-Acylierung ist die Verwendung großer Mengen an AlCl3, Polyphosphorsäure oder PCl5 für die Darstellung der eingesetzten Säurechloride, die erheblichen Aufarbeitungsaufwand und Abfallvolumen verursachen.
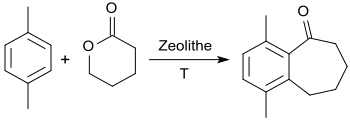
Für die Reaktion von Benzol mit γ-Butyrolacton wurde auch die Verwendung von festen sauren Katalysatoren auf Basis von Zeolithen und Alumosilikaten vorgeschlagen, aber keine Angaben zu ihrer Effizienz gemacht.[19] Auf diesem Weg ist mit dem Sechsring-Lacton δ-Valerolacton das Siebenring-Keton 1-Benzosuberon zugänglich.
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
1-Tetralon ist eine klare, hellgelbe bis dunkelbraune Flüssigkeit mit schwachem Geruch,[20] die mit Wasser praktisch nicht mischbar ist. Mit unpolaren organischen Lösungsmitteln ist α-Tetralon mischbar.
Anwendungen[Bearbeiten | Quelltext bearbeiten]
1-Tetralon lässt sich mit Lithium in flüssigem Ammoniak in einer Birch-Reduktion mit 96%iger Ausbeute zu Tetralin reduzieren.[21]

Bei veränderter Prozessführung und Zugabe von wässriger Ammoniumchlorid-Lösung nach Abdampfen des Ammoniaks wird die Ketogruppe zum sekundären Alkohol reduziert und man erhält 1-Tetralol in 70%iger Ausbeute.[22]
Mit Calcium in flüssigem Ammoniak bei −33 °C erfolgt Reduktion zum 1-Tetralol in 81%iger Ausbeute.[23]
Die zur Ketogruppe α-ständige Methylengruppe ist besonders reaktiv und wird von Formaldehyd in Form des trimeren Paraldehyd in Gegenwart des Trifluoressigsäuresalzes von N-Methylanilin mit Ausbeuten bis 91 % zum 2-Methylen-1-tetralon umgesetzt.

Das 2-Methylenketon ist bei Temperaturen unter −5 °C haltbar, polymerisiert jedoch bei Raumtemperatur innerhalb 12 Stunden vollständig.[24]
Bei der Pfitzinger-Reaktion von Isatin mit 1-Tetralon entsteht die als Tetrophan bezeichnete 3,4-Dihydro-1,2-benzacridin-5-carbonsäure.

Die Reaktivität der α-ständigen Methylengruppe macht sich auch die Reaktion von 1-Tetralon mit Methanol bei 270–290 °C zunutze, bei der unter Dehydrierung und Ausbildung des aromatischen Naphthalin-Ringsystems in 66%iger Ausbeute 2-Methyl-1-naphthol entsteht.[25]

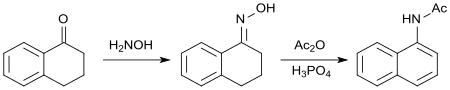
Bei der Reaktion des Oxims von 1-Tetralon mit Acetanhydrid entsteht unter Aromatisierung des Cycloalkanonrings N-(1-Naphthyl)acetamid,[26] das wie 1-Naphthylessigsäure als synthetisches Auxin wirksam ist.
Der bei der Grignard-Reaktion von 1-Tetralon mit Phenylmagnesiumbromid entstehende tertiäre Alkohol reagiert mit Acetanhydrid unter Wasserabspaltung zum 1-Phenyl-3,4-dihydronaphthalin, das mit elementarem Schwefel in einer Gesamtausbeute von ca. 45 % zum 1-Phenylnaphthalin dehydriert wird.[27]

Die Ruthenium(II)-katalysierte Arylierung von 1-Tetralon mittels Phenylboronsäure-neopentylglycolester liefert 8-Phenyl-1-tetralon in bis zu 86%iger Ausbeute.[28]

Mit 5-Aminotetrazol und einem aromatischen Aldehyd reagiert 1-Tetralon in einer Mehrkomponentenreaktion unter Mikrowellenbestrahlung zu einem viergliedrigen heterocyclischen Ringsystem.[29]

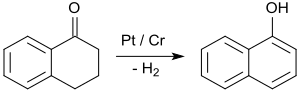
Die weitaus wichtigste Anwendung von 1-Tetralon liegt in der Synthese von 1-Naphthol durch aromatisierende Dehydrierung, z. B. an Platin-Katalysatoren bei Temperaturen von 200 bis 450 °C.[30]
1-Naphthol ist Ausgangsstoff für das Insektizid Carbaryl und die Betablocker Propranolol[31] und Nadolol,[32][33] sowie für das Antidepressivum Sertralin[34] und das Anti-Protozoen-Therapeutikum Atovaquon.[35]
Die Anwendung des 1-Tetralons als Gift gegen Kleidermotten[20] hat sich trotz seines „kaum noch unangenehm auf die menschlichen Sinnesorgane wirkenden Geruchs“ am Markt nicht durchgesetzt.
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e Eintrag zu α-Tetralone bei TCI Europe, abgerufen am 25. November 2017.
- ↑ a b c d e f Datenblatt α-Tetralon bei Sigma-Aldrich, abgerufen am 25. November 2017 (PDF).
- ↑ a b William M. Haynes: CRC Handbook of Chemistry and Physics, 97th Edition. CRC Press, Boca Raton, FL, U.S.A. 2016, ISBN 978-1-4987-5429-3, S. 3–504.
- ↑ a b c H.R. Snyder, F.X. Werber: α-Tetralone In: Organic Syntheses. 20, 1940, S. 94, doi:10.15227/orgsyn.020.0094; Coll. Vol. 3, 1955, S. 798 (PDF).
- ↑ a b c d C.E. Olson, A.R. Bader: α-Tetralone In: Organic Syntheses. 35, 1955, S. 95, doi:10.15227/orgsyn.035.0095; Coll. Vol. 4, 1963, S. 898 (PDF).
- ↑ a b D.-M. Cui, M. Kawamura, S. Shimada, T. Hayashi, M. Tanaka: Synthesis of 1-tetralones by intramolecular Friedel-Crafts reaction of 4-arylbutyric acids using Lewis acid catalysts. In: Tetrahedron Lett. Band 44, Nr. 21, 2003, S. 4007–4010, doi:10.1016/S0040-4039(03)00855-4.
- ↑ Datenblatt 1-Tetralone, 97% bei Alfa Aesar, abgerufen am 25. November 2017 (Seite nicht mehr abrufbar).
- ↑ P.-C. Kuo, Y.-C. Li, T.-S. Wu: Chemical constituents and pharmacology of the Aristolochia species. In: eJTCM. Band 2, Nr. 4, 2012, S. 249–266, doi:10.1016/S2225-4110(16)30111-0.
- ↑ H. Hock, W. Susemihl: Autoxydation von Kohlenwasserstoffen: Über ein durch Autoxydation erhaltenes Tetrahydro-naphthalin-peroxyd (I. Mitteil.). In: Ber. Dtsch. Chem. Ges. Band 66, Nr. 1, 1933, S. 61–68, doi:10.1002/cber.19330660113.
- ↑ S. Bhattacharjee, Y.-R. Lee, W.-S. Ahn: Oxidation of tetraline to 1-tetralone over CrAPO-5. In: Korean J. Chem. Eng. Band 34, Nr. 3, 2017, S. 701–705, doi:10.1007/s11814-016-0310-4.
- ↑ Patent US4473711: Liquid-phase process for oxidation of tetralin. Angemeldet am 6. August 1981, veröffentlicht am 25. September 1984, Anmelder: Union Carbide Corp., Erfinder: R.W. Coon.
- ↑ William M. Haynes: CRC Handbook of Chemistry and Physics, 97th Edition. CRC Press, Boca Raton, FL, U.S.A. 2016, ISBN 978-1-4987-5429-3, S. 3–502.
- ↑ L.F. Somerville, C.F.H. Allen: β-Benzoylpropionic acid In: Organic Syntheses. 13, 1933, S. 12, doi:10.15227/orgsyn.013.0012; Coll. Vol. 2, 1943, S. 81 (PDF).
- ↑ Patent US6372938B1: Synthesis of 4-Phenylbutyric acid. Angemeldet am 21. Mai 2001, veröffentlicht am 16. April 2002, Anmelder: S.R. Burzynski, Erfinder: S.R. Burzynski, L. Musial.
- ↑ V. Premasagar, V.A. Palaniswamy, E.J. Eisenbraun: Methanesulfonic acid catalyzed cyclization of 3-arylpropanoic and 4-arylbutanoic acids to 1-indanones and 1-tetralones. In: J. Org. Chem. Band 46, Nr. 14, 1981, S. 2974–2976, doi:10.1021/jo00325a028.
- ↑ M.S. Holden, R.D. Crouch, K.A. Barker: Formation of α-tetralone by intramolecular Friedel-Crafts acylation. In: J. Chem. Educ. Band 82, Nr. 6, 2005, S. 934–935, doi:10.1021/ed082p934.
- ↑ S. Antoniotti, E. Dunach: Facile preparation of metallic triflates and triflimidates by oxidative dissolution of metal powders. In: Chem. Commun. Band 8, 2008, S. 993–995, doi:10.1039/B717689A.
- ↑ H. Motiwala, R.H. Vekariya, J. Aubé: Intramolecular Friedel-Crafts acylation reaction promoted by 1,1,1,3,3,3-hexafluoro-2-propanol. In: Org. Lett. Band 17, 2015, S. 5484–5487, doi:10.1021/acs.orglett.5b02851.
- ↑ SDK develops new catalyst for tetralone synthesis. In: Showa Denko K.K. News Release 2004. Showa Denko K.K., abgerufen am 1. Dezember 2017.
- ↑ a b Patent DE357063: Verfahren, um Pelzwerk und Wollstoffe gegen Motten und andere Insekten zu schützen. Angemeldet am 25. Oktober 1921, veröffentlicht am 15. August 1922, Anmelder: Vereinigte Chemische Fabriken Julius Norden & Co..
- ↑ S.S. Hall, S.D. Lipsky, F.J. McEnroe, A.P. Bartels: Lithium-ammonia reduction of aromatic ketones to aromatic hydrocarbons. In: J. Org. Chem. Band 38, Nr. 18, 1971, S. 2588–2591, doi:10.1021/jo00817a004.
- ↑ Z. Marcinow, P.W. Rabideau: Metal-ammonia reduction of α-tetralone. Competition between ring reduction, carbonyl reduction, and dimer formation. In: J. Org. Chem. Band 53, Nr. 9, 1988, S. 2117–2119, doi:10.1021/jo00244a054.
- ↑ J.R. Hwu, Y.S. Wein, Y.-J. Leu: Calcium metal in liquid ammonia for selective reduction of organic compounds. In: J. Org. Chem. Band 61, Nr. 4, 1996, S. 1493–1499, doi:10.1021/jo951219c.
- ↑ J.-L. Gras: Methylene ketones and aldehydes by simple, direct methylene transfer: 2-Methylene-1-oxo-1,2,3,4-tetrahydronaphthalene In: Organic Syntheses. 60, 1981, S. 88, doi:10.15227/orgsyn.060.0088; Coll. Vol. 7, 1990, S. 332 (PDF).
- ↑ I. Yuranov, L. Kiwi-Minsker, A. Renken: One-step vapour-phase synthesis of 2-methyl-1-naphthol from 1-tetralone. In: Appl. Catal. A. Band 226, Nr. 1–2, 2002, S. 193–198, doi:10.1016/S0926-860X(01)00902-4.
- ↑ M.S. Newman, W.M. Hung: An improved aromatization of α-tetralone oximes to N-(1-naphthyl)acetamides. In: J. Org. Chem. Band 38, Nr. 23, 1973, S. 4073–4074, doi:10.1021/jo00987a029.
- ↑ R. Weiss: 1-Phenylnaphthalene In: Organic Syntheses. 24, 1944, S. 84, doi:10.15227/orgsyn.024.0084; Coll. Vol. 3, 1955, S. 729 (PDF).
- ↑ K. Kitazawa, T. Kochi, F. Kakiuchi: Ruthenium-catalyzed arylation of ortho C-H bond in an aromatic with an arylboronate: 8-Phenyl-1-tetralone In: Organic Syntheses. 87, 2009, S. 209–217, doi:10.15227/orgsyn.087.0209; Coll. Vol. 11, 2009, S. 1210–1216 (PDF).
- ↑ G.P. Kantin, M. Krasavin: Reaction of α-tetralone, 1H-tetrazol-5-amine, and aromatic aldehydes upon microwave irradiation – a convenient method for the synthesis of 5,6,7,12-tetrahydrobenzo[h]tetrazolo[5,1-b]quinazolines. In: Chem. Heterocycl. Compd. Band 52, Nr. 11, 2016, S. 918–922, doi:10.1007/s10593-017-1985-0.
- ↑ Patent DE2421745: Verfahren zur Herstellung von α-Naphthol durch katalytische Dehydrierung von α-Tetralon. Angemeldet am 6. Mai 1974, veröffentlicht am 20. November 1975, Anmelder: Sumitomo Chemical Co., Ltd., Erfinder: K. Kudo, T. Ohmae, A. Uno.
- ↑ C. Kaiser, T. Jen, E. Garvey, W.D. Bowen, D.F. Colella, J.R. Wardell Jr.: Adrenergic agents. 4. Substituted phenoxypropanolamine derivatives as potential β-adrenergic agonists. In: J. Med. Chem. Band 20, Nr. 5, 1977, S. 687–689, doi:10.1021/jm00215a014.
- ↑ Patent DE2258995: 2,3-cis-1,2,3,4-Tetrahydro-5[2-hydroxy-3-(tert.-butylamino)-propoxy]-2,3-naphthalindiol. Angemeldet am 1. Dezember 1972, veröffentlicht am 7. Juni 1973, Anmelder: E.R. Squibb & Sons, Inc., Erfinder: F.R. Hauck, C.M. Cimarusti, V.L. Narayan.
- ↑ M.E. Condon et al.: Nondepressant β-adrenergic blocking agents. 1. Substituted 3-amino-1-(5,6,7,8-tetrahydro-1-naphthoxy)-2-propanols. In: J. Med. Chem. Band 21, Nr. 9, 1978, S. 913–922, doi:10.1021/jm00207a014.
- ↑ K. Vukics, T. Fodor, J. Fischer, I. Fellevári, S. Lévai: Improved industrial synthesis of antidepressant Sertraline. In: Org. Process Res. Dev. Band 6, Nr. 1, 2002, S. 82–85, doi:10.1021/op0100549.
- ↑ B.N. Roy, G.P. Singh, P.S. Lathi, M.K. Agarwal: A novel process for synthesis of Atovaquone. In: Indian J. Chem. 52B, 2013, S. 1299–1312 (res.in [PDF]).
