2-Ethyl-2-oxazolin
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 2-Ethyl-2-oxazolin | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C5H9NO | |||||||||||||||
| Kurzbeschreibung |
farblose bis schwach gelbe Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 99,13 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt |
−62 °C[2] | |||||||||||||||
| Siedepunkt | ||||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Brechungsindex | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
2-Ethyl-2-oxazolin (EtOx) ist ein 2-Oxazolin-Derivat und ein cyclischer Imidsäureester. Die Verbindung findet Verwendung insbesondere als Monomer zur kationischen ringöffnenden Polymerisation zu Poly(2-alkyloxazoline)n[8], die als gut wasserlösliche und biokompatible Materialien für biomedizinische Anwendungen untersucht werden.[9]
Herstellung[Bearbeiten | Quelltext bearbeiten]
Aus Propionsäure und -derivaten[Bearbeiten | Quelltext bearbeiten]
Aus Carbonsäuren, Carbonsäureestern, Carbonsäureamiden und Nitrilen sind mit 2-Aminoalkoholen durch Erhitzen auf 200 °C unter Dehydratisierung die entsprechenden N-(2-Hydroxyalkyl)carbamide zugänglich, die bei weiterem Erhitzen auf 260–280 °C unter erneuter Wasserabspaltung in 2-Alkyl-2-oxazoline übergehen.

So wird aus Propionsäure und Monoethanolamin (MEA) zunächst N-(2-Hydroxyethyl)propionamid in 74%iger Ausbeute gebildet, das in ca. 75%iger Ausbeute zu 2-Ethyl-2-oxazolin dehydratisiert werden kann.[3]

Weniger drastische Reaktionsbedingungen erfordert die Dehydratisierung des N-(2-Hydroxyethyl)propionamids im Vakuum in Gegenwart von Eisen(III)-chlorid, das Produkt in 90%iger Ausbeute liefert.[10]
Noch höhere Ausbeuten von 96,2 % werden durch Erhitzen mit Zinkacetat-Dihydrat erzielt.[11]
Eine als Eintopfreaktion ökonomische Route ist das Erhitzen des Salzes der Propionsäure mit Ethanolamin auf 200 °C im Vakuum in Gegenwart von Zinkchlorid-dihydrat, die 2-Ethyl-2-oxazolin in einer Ausbeute von 82 % liefert.[11] Reines 2-Ethyl-2-oxazolin kann aus dem wasserhaltigen Destillat durch Extraktion mit Diethylbenzol und anschließende Destillation[11] isoliert bzw. durch Destillation mit Diethylphosphit oder Dimethyldichlorsilan gereinigt und bis auf einen Restwassergehalt von 10 ppm getrocknet werden.[12]
Eine weitere Eintopfreaktion ist die dreistufige Umsetzung von Propionsäure mit 2-Aminoethanol zum 2-Hydroxyethylamid, das mit Borsäure bei 130 °C zum Borsäureester reagiert, der bei 280 °C in 92%iger Ausbeute zum 2-Ethyl-2-oxazolin thermolysiert wird.[13]

Das aus Propionsäure und Thionylchlorid erhaltene Propionylchlorid bildet mit MEA in Gegenwart von z. B. Pyridin als Säurefänger N-Propionyl-2-aminoethanol, das mit weiterem Thionylchlorid unter Bildung des 2-Chlorethylamids reagiert. Mit dem Chloridion als besserer Abgangsgruppe wird diese Zwischenstufe durch Erhitzen einfacher zum Oxazolin cyclisiert. Wegen der Neigung von Oxazolinen zur Ringöffnung durch Chloridionen bei Protonierung des Imin-Stickstoffs muss unter Wasserausschluss gearbeitet werden.[14]

Die direkte Umsetzung von Propanoylchlorid mit 2-Chlorethylamin-hydrochlorid in Gegenwart von Triethylamin vermeidet die Entstehung von Wasser.

Aus Propionaldehyd[Bearbeiten | Quelltext bearbeiten]
Propionaldehyd reagiert mit 2-Aminoethanol in tert-Butanol in Gegenwart des Iodierungsreagenzes 1,3-Diiod-5,5-dimethylhydantoin (DIH) und Kaliumcarbonat zu 2-Ethyl-2-oxazolin.[15]

Eigenschaften[Bearbeiten | Quelltext bearbeiten]
2-Ethyl-2-oxazolin ist eine gut wasserlösliche, aminartig riechende,[5] farblose Flüssigkeit, die auch in einer Vielzahl von organischen Lösungsmitteln löslich ist. Wässrige Lösungen reagieren alkalisch. Die Verbindung ist im Alkalischen stabil und hydrolysiert unter Säureeinwirkung.
Anwendungen[Bearbeiten | Quelltext bearbeiten]
In wasserfreier Form findet 2-Ethyl-2-oxazolin im Wesentlichen Anwendung als Monomer.[8]
Die kationische ringöffnende Polymerisation von 2-Ethyl-2-oxazolin[7] wird durch Alkylierung mit z. B. Methyltosylat oder Triflaten (insbesondere Methyltriflat) initiiert und führt zu dem wasserlöslichen Poly(2-ethyl-2-oxazolin), das ein N-propionylsubstituiertes lineares Polyethylenimin darstellt und auch als Pseudo-Polypeptid aufgefasst werden kann.[16]
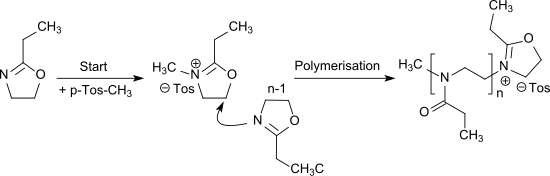
Die Polymerisation von EOx kann auch als lebende kationische Polymerisation ausgeführt werden.[17]
Copolymere mit anderen 2-Alkyl-2-oxazolinen[18] und anderen Monomeren[19] erlauben die Darstellung von statistischen Copolymeren und Blockcopolymeren.
Die erhaltenen Copolymeren können als biokompatible Wirkstoffträger[20] (engl. drug carrier), in Beschichtungen und Klebstoffen sowie in vielen anderen Anwendungen[6] eingesetzt werden.
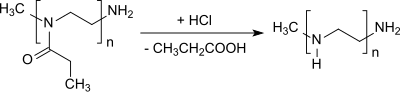
Die Abspaltung der Propionylgruppe von Poly(2-ethyl-2-oxazolin) liefert lineares Polyethylenimin.[21][22]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Eintrag zu 2-Ethyl-2-oxazoline bei TCI Europe, abgerufen am 5. Juni 2016.
- ↑ a b c d e f Datenblatt 2-Ethyl-2-oxazolin bei Sigma-Aldrich, abgerufen am 23. Oktober 2021 (PDF).
- ↑ a b c H. Wenker: The synthesis of Δ2-oxazolines and Δ2-thiazolines from N-acyl-2-aminoethanols. In: J. Amer. Chem. Soc. Band 57, Nr. 6, 1935, S. 1079–1080, doi:10.1021/ja01309a034.
- ↑ a b H. Witte, W. Seeliger: Cyclische Imidsäureester aus Nitrilen und Aminoalkoholen. In: Justus Liebigs Ann. Chem. Band 6, 1974, S. 996–1009, doi:10.1002/jlac.197419740615.
- ↑ a b c Datenblatt 2-Ethyl-2-oxazoline bei Alfa Aesar, abgerufen am 5. Juni 2016 (Seite nicht mehr abrufbar).
- ↑ a b Etox, 2-Ethyl-2-Oxazoline, Product Information Sheet. Polymer Chemistry Innovations, Inc., abgerufen am 19. Juli 2016 (englisch).
- ↑ a b B.L. Rivas, S.I. Ananias: Ring-opening polymerization of 2-ethyl-2-oxazoline. In: Polym. Bull. Band 18, Nr. 3, 1987, S. 189–194, doi:10.1007/BF00255109.
- ↑ a b T. Kagiya, S. Narisawa, T. Maeda, K. Fukui: Ring-opening polymerization of 2-substituted 2-oxazolines. In: J. Polym. Chem., Polym. Lett. Band 4, Nr. 7, 2003, S. 441–445, doi:10.1002/pol.1966.110040701.
- ↑ R. Hoogenboom: Poly(2-oxazoline)s: A polymer class with numerous potential applications. In: Angew. Chem. Int. Ed. Band 48, Nr. 43, 2009, S. 7978–7994, doi:10.1002/anie.200901607.
- ↑ Patent US4203900: Process for preparing 2-oxazolines. Angemeldet am 3. Januar 1977, veröffentlicht am 20. Mai 1980, Anmelder: The Dow Chemical Co., Erfinder: M.E. Kaiser.
- ↑ a b c Patent US4354029: Preparation of 2-substituted 2-oxazolines with organic zinc salt catalysts. Angemeldet am 30. November 1981, veröffentlicht am 12. Oktober 1982, Anmelder: The Dow Chemical Co., Erfinder: M.E. Kaiser, D.L. Larson.
- ↑ Patent US4281137: Purification of 2-oxazolines. Angemeldet am 20. Februar 1980, veröffentlicht am 28. Juli 1981, Anmelder: The Dow Chemical Co., Erfinder: J.W. Sanner, P.W. Owen.
- ↑ B. Ilkgul, D. Gunes, O. Sirkecioglu, N. Bicak: Synthesis of 2-oxazolines via boron esters of N-(2-hydroxyethyl) amides. In: Tetrahedron Lett. Band 51, Nr. 40, 2010, S. 5313–5315, doi:10.1016/tetlet.2010.07.167.
- ↑ M.N. Holerca, V. Percec: 1H NMR Spectroscopic Investigation of the Mechanism of 2-Substituted-2-Oxazoline Ring Formation and of the Hydrolysis of the Corresponding Oxazolinium Salts. In: Eur. J. Org. Chem. Band 2000, Nr. 12, 2000, S. 2257–2263, doi:10.1002/1099-0690(200006)2000:12<2257::AID-EJOC2257>3.0.CO;2-2.
- ↑ S. Takahashi, H. Togo: An Efficient Oxidative Conversion of Aldehydes into 2-Substituted 2-Oxazolines Using 1,3-Diiodo-5,5-dimethylhydantoin. In: Synthesis. Band 14, 2009, S. 2329–2332, doi:10.1055/s-0029-1216843.
- ↑ H. Schlaad, R. Hoogenboom: Poly(2-oxazoline)s and Related Pseudo-Polypeptides. In: Macromol. Chem. Rapid Commun. Band 33, Nr. 19, 2012, S. 1599, doi:10.1002/marc.201200571.
- ↑ C. Guerrero-Sanchez, R. Hoogenboom, U.S. Schubert: Fast and “green” living cationic ring opening polymerization of 2-ethyl-2-oxazoline in ionic liquids under microwave irradiation. In: Chem. Commun. Band 36, 2006, S. 3797–3799, doi:10.1039/B608364A.
- ↑ M. Glassner, K. Lava, V.R. de la Rosa, R. Hoogenboom: Tuning the LCST of poly(2-cyclopropyl-2-oxazoline) via gradient copolymerization with 2-ethyl-2-oxazoline. In: Polym. Chem. Band 52, Nr. 21, 2014, S. 3118–3122, doi:10.1002/pola.27364.
- ↑ S. Motokucho, M. Furukawa, M. Kawashima, K. Kojio, K. Yoshinaga: Physical properties of poly(tetrahydrofuran)-block-poly(2-ethyl-2-oxazoline) triblock copolymer. In: Polym. J. Band 45, 2013, S. 1115–1119, doi:10.1038/pj.2013.39.
- ↑ V.R. de la Rosa: Poly(2-oxazoline)s as materials for biomedical applications. In: J. Mater. Sci. Mater. Med. Band 25, Nr. 5, 2013, S. 1–15, doi:10.1007/s10856-013-5034-y.
- ↑ Patent US20100197888A1: Method for manufacturing linear polyethyleneimine (PEI) for transfection purpose and linear PEI obtained with such method. Angemeldet am 31. Juli 2008, veröffentlicht am 5. August 2010, Anmelder: Polyplus Transfection, Erfinder: A. Adib, F. Stock, P. Erbacher.
- ↑ H.M.L. Lambermont-Thijs, F.S. van der Woerdt, A. Baumgaertel, L. Bonami, F.E. Du Prez, U.S. Schubert, R. Hoogenboom: Linear Poly(ethylene imine)s by Acidic Hydrolysis of Poly(2-oxazoline)s: Kinetic Screening, Thermal Properties, and Temperature-Induced Solubility Transitions. In: Macromolecules. Band 43, Nr. 2, 2010, S. 927–933, doi:10.1021/ma9020455.

