2-Methylenglutaronitril
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 2-Methylenglutaronitril | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C6H6N2 | |||||||||||||||
| Kurzbeschreibung |
klare, farblose[1] Flüssigkeit | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 106,13 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt |
−9,6 °C[2] | |||||||||||||||
| Siedepunkt | ||||||||||||||||
| Löslichkeit |
wasserlöslich,[1] löslich in Chloroform[4] | |||||||||||||||
| Brechungsindex |
1,456 bei 25 °C (589 nm)[5] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
2-Methylenglutaronitril ist ein Dimerisierungsprodukt von Acrylnitril und Ausgangsstoff für Di- und Triamine, für das Biozid 2-Brom-2-(brommethyl)pentandinitril und für Heterocyclen, wie z. B. 3-Cyanpyridin.
Vorkommen und Darstellung[Bearbeiten | Quelltext bearbeiten]
Neben der elektrochemischen Hydrodimerisierung ist die katalytische Dimerisierung von Acrylnitril eine auch industriell bedeutende Reaktion zur Herstellung von Adiponitril, das nach Hydrierung zum 1,6-Diaminohexan eine Schlüsselkomponente für technische Polymere, wie z. B. Polyamide (PA 66) oder Polyurethane darstellt.
Wenn statt einer Schwanz-Schwanz-Verknüpfung zweier Acrylnitrilmoleküle wie bei der Bildung von Adiponitril

eine Kopf-Schwanz-Verknüpfung eintritt, erhält man bei der katalytischen Dimerisierung z. B. in Gegenwart von Tricyclohexylphosphin PCy3 in bis zu 77%iger Ausbeute 2-Methylenglutaronitril.[3]

Als Katalysatoren für die Dimerisierung werden Metallhalogenide, wie z. B. Zinkchlorid[6][7] oder Aluminiumchlorid[8] mit tertiären Aminen, wie z. B. Triethylamin eingesetzt und Rohausbeuten von bis zu 84 % erzielt.[6]
Bei der Aufarbeitung, z. B. durch Extraktion, und der destillativen Aufarbeitung gehen wegen der Polymerisationsneigung von 2-Methylenglutaronitril oft erhebliche Mengen an Reinprodukt verloren.
Neben den linearen Dimerisierungsprodukten 1,4-Dicyano-2-buten und 1,4-Dicyano-3-buten, die als cis-trans-Isomerengemische vorliegen, treten meist auch weitere Oligomere (und Polymere) des Acrylnitrils auf. So entstehen bei der elektrochemischen Hydrooligomerisierung von Acrylnitril Trimere, wie z. B. 1,3,6- und 1,3,5-Tricyanohexan bzw. Tetramere, wie 1,3,6,8- und 1,3,5,8-Tetracyanooctan auf.[9]
Die Umsetzung von Acrylnitril mit Tributylphosphin liefert 2-Methylenglutaronitril nach fraktionierter Destillation in bescheidenen Ausbeuten von ca. 10 %.[10] Auch die DABCO-katalysierte Acrylnitrildimerisierung mit 40%iger Ausbeute an 2,4-Dicyano-1-buten nach 10 Tagen bei Raumtemperatur ist unergiebig.[11]
Verwendung[Bearbeiten | Quelltext bearbeiten]
In der älteren Patentliteratur sind Verfahren zur Isomerisierung von 2-Methylenglutaronitril zu 1,4-Dicyanobutenen als Adiponitrilvorstufen beschrieben, die mit der Optimierung der elektrochemischen Hydrodimerisierung von Acrylnitril zu Adiponitril obsolet wurden.[12]
Die elektrochemische Hydrodimerisierung von 2-Methylenglutaronitril erzeugt 1,3,6,8-Tetracyanooctan.[10]

Bei der Hydrierung von 2,4-Dicyano-1-buten wird der Wasserstoff in Gegenwart von Palladium auf Aktivkohle zunächst an die Doppelbindung angelagert und in praktisch quantitativer Ausbeute 2-Methylglutaronitril erhalten.[13]
Die Hydrierung der Nitrilgruppen erfordert drastischere Bedingungen und die Anwesenheit von Ammoniak oder Aminen, um die Bildung sekundärer Amine zu unterdrücken. Diese zweite Hydrierstufe wird mit Raney-Cobalt als Hydrierkatalysator durchgeführt und liefert 2-Methyl-1,5-diaminopentan in 80%iger Ausbeute.[14]

Die Hydrierung in Gegenwart von Ammoniak mit manganhaltigem und Natriumoxid-dotiertem Cobalt als Katalysator bei 80 bis 100 °C und Drücken von 200 atm in einem Rohrreaktor überführt 2,4-Dicyano-1-buten unter Addition von Ammoniak an die Doppelbindung direkt in 2-Aminomethyl-1,5-pentandiamin mit Ausbeuten von 66 %.[15]
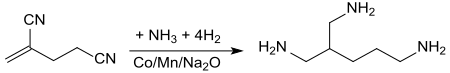
Das verzweigte Triamin kann in Epoxiden und Polyurethanen Verwendung finden.
2-Methylenglutaronitril reagiert mit Formamid unter Katalyse mit 4-(Dimethylamino)pyridin (DMAP) bei 60 °C in 47%iger Ausbeute zu 1-(N-Formylamino)-2,4-dicyanobutan, aus dem durch anschließende Hydrolyse α-Aminomethylglutarsäure entsteht.[16]

Beim Erhitzen von 2-Methylenglutaronitril mit alkalischem Ionenaustauscher, Pyridin und Wasser auf 150 °C in einem Autoklaven entsteht in 80%iger Ausbeute das Lactam 5-Cyano-2-piperidon.[17]

Auch Homo- und Copolymere können mit 2-Methylenglutaronitril durch anionische Polymerisation mit Natriumcyanid, Natrium in flüssigem Ammoniak oder mit Butyllithium erzeugt werden, die allerdings nur in sehr geringen Ausbeuten anfallen und unbefriedigende Eigenschaften, wie z. B. niedrige inhärente Viskositäten und schlechte mechanische Eigenschaften aufweisen.[18]
Die wichtigste Verwendung von 2-Methylenglutaronitril ist als Ausgangsstoff für das Breitspektrumbiozid 2-Brom-2-(brommethyl)pentandinitril (Methyldibromoglutaronitril),[19] das bei der Addition von Brom an die Doppelbindung in praktisch quantitativer Ausbeute gebildet wird.[20]

Aus dem chloranalogen 2-Chlor-2-(chlormethyl)pentandinitril wird durch Erhitzen auf 150 °C mit Zinn(IV)-chlorid 3-Cyanpyridin erhalten.[19]

Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c Eintrag zu 2-Methyleneglutaronitrile bei TCI Europe, abgerufen am 25. Juni 2017.
- ↑ a b c d e Datenblatt 2-Methylenglutaronitril bei Sigma-Aldrich, abgerufen am 23. März 2022 (PDF).
- ↑ a b L. Yu et al.: Practical and scalable preparation of 2-methyleneglutaronitrile via an efficient and highly selective head-to-tail dimerization of acrylonitrile catalysed by low-loading of tricyclohexylphosphine. In: RSC Adv. Band 4, 2014, S. 19122–19126, doi:10.1039/C4RA02810D.
- ↑ William M. Haynes: CRC Handbook of Chemistry and Physics, 97th Edition. CRC Press, Boca Raton, FL, U.S.A. 2017, ISBN 978-1-4987-5429-3, S. 3–370.
- ↑ Carl L. Yaws: Thermophysical Properties of Chemicals and Hydrocarbons, 2nd Edition. Elsevier Inc., Oxford, UK 2015, ISBN 978-0-323-28659-6, S. 100.
- ↑ a b Patent US3733351: Production of 2-methylene-glutaronitrile. Angemeldet am 25. April 1969, veröffentlicht am 15. Mai 1973, Anmelder: Mitsubishi Petrochemical Co., Erfinder: Y. Watanabe, M. Takeda.
- ↑ Patent US4422981: Process for production of 2-methyleneglutaronitrile. Angemeldet am 24. März 1982, veröffentlicht am 27. Dezember 1983, Anmelder: Mitsubishi Petrochemical Co., Erfinder: H. Omori, M. Takeda, K. Fujita, M. Kataoka.
- ↑ Patent US3956358: Dimerization method. Angemeldet am 30. Dezember 1974, veröffentlicht am 11. Mai 1976, Anmelder: Halcon International, Inc., Erfinder: O.T. Onsager.
- ↑ M.M. Baizer, J.D. Anderson: Electrolytic reductive coupling. VII. A new class of acrylonitrile oligomers. In: J. Org. Chem. Band 30, Nr. 5, 1965, S. 1351–1356, doi:10.1021/jo01016a003.
- ↑ a b M.M. Baizer, J.D. Anderson: Electrolytic reductive coupling. VIII. Utilization and a new preparation of α-methyleneglutaronitrile. In: J. Org. Chem. Band 30, Nr. 5, 1965, S. 1357–1360, doi:10.1021/jo01016a004.
- ↑ D. Basavaiah, V.V.L. Gowriswari, T.K. Barathi: DABCO catalyzed dimerization of α, β-unsaturated ketones and nitriles. In: Tetrahedron Lett. Band 28, Nr. 39, 1987, S. 4591–4592, doi:10.1016/S0040-4039(00)96573-0.
- ↑ Patent US3795694: Preparation of cyano compounds. Angemeldet am 16. Oktober 1972, veröffentlicht am 5. März 1974, Anmelder: Halcon International, Inc., Erfinder: O.T. Onsager.
- ↑ Patent US3350439: Process for preparing aminoalkanenitriles. Angemeldet am 1. Juni 1965, veröffentlicht am 31. Oktober 1967, Anmelder: National Destillers and Chemical Corp., Erfinder: J. Feldman, M. Thomas.
- ↑ Patent US3408397: Methyl pentamethylene diamine process. Angemeldet am 1. Juni 1965, veröffentlicht am 31. Oktober 1967, Anmelder: National Destillers and Chemical Corp., Erfinder: J. Feldman, M. Thomas.
- ↑ Patent EP1028104A1: Verfahren zur Herstellung von 2-Aminomethyl-1,5-pentandiamin. Angemeldet am 27. Januar 2000, veröffentlicht am 16. August 2000, Anmelder: Bayer AG, Erfinder: K. Fischer, F. Richter, A. Bazanov, A. Timofeev, N. Zubritskaya, G. Smirnova.
- ↑ Patent EP0336185A1: 1-(N-Formylamino)-2,4-dicyanobutan und ein Verfahren zu dessen Herstellung. Angemeldet am 18. März 1989, veröffentlicht am 11. Oktober 1989, Anmelder: Bayer AG, Erfinder: H.-J. Scholl.
- ↑ Patent US3666766: Selective hydrolysis and cyclization of unsaturated nitriles. Angemeldet am 27. Dezember 1967, veröffentlicht am 30. Mai 1972, Anmelder: National Distillers and Chemical Corp., Erfinder: J.B. Pedigo, J. Feldman, I.A. Kereszies.
- ↑ Patent US3451977: Process for polymerizing 2-methylene glutaronitrile. Angemeldet am 27. Juli 1964, veröffentlicht am 24. Juni 1969, Anmelder: National Distillers and Chemical Corp., Erfinder: J.M. Hoyt, K. Koch.
- ↑ a b Patent US3644380: Preparation of 3-cyanopyridine. Angemeldet am 24. November 1969, veröffentlicht am 22. Februar 1972, Anmelder: Merck & Co., Inc., Erfinder: R. Harmetz, R.J. Tull.
- ↑ Patent US3929858: Method for preparing 2-bromo-2-bromomethyl-glutaronitrile. Angemeldet am 3. Dezember 1974, veröffentlicht am 30. Dezember 1975, Anmelder: Merck & Co., Inc., Erfinder: R.D. Swigert.
