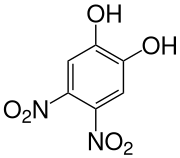
4,5-Dinitrobrenzcatechin
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | 4,5-Dinitrobrenzcatechin | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C6H4N2O6 | ||||||||||||
| Kurzbeschreibung |
gelbe Kristalle[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 200,1 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
4,5-Dinitrobrenzcatechin ist eine chemische Verbindung, die sowohl zu den Phenolen als auch zu den Nitroaromaten gehört.
Darstellung[Bearbeiten | Quelltext bearbeiten]
Die Synthese geht vom Veratrol 1 aus, das mit Salpetersäure und Schwefelsäure zum 4,5-Dinitroveratrol 2 nitriert wird.[3] Mit Bromwasserstoffsäure werden dann die Methylgruppen abgespalten. Dabei entsteht das Endprodukt 4,5-Dinitrobrenzcatechin 3.[4]

Derivate[Bearbeiten | Quelltext bearbeiten]
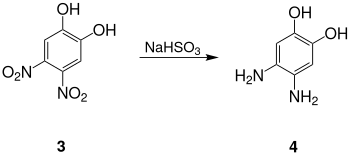
Das Dinatriumsalz des 4,5-Dinitrobrenzcatechins ist blau gefärbt.[4]
Mit Natriumhydrogensulfit findet in wässriger Lösung eine Reduktion zum 4,5-Diaminobrenzcatechin 4 statt.[4]
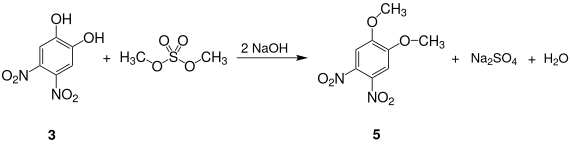
Monomethylierung mit Dimethylsulfat führt zum 4,5-Dinitroguajacol, das gelbe Kristalle bildet[1] und dessen Schmelzpunkt bei 172–173 °C liegt[4]. Vollständige Methylierung führt zum 4,5-Dinitroveratrol 5, das ebenfalls gelbe Kristalle bildet und dessen Schmelzpunkt bei 130–132 °C liegt.[1]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d J. Buckingham: Dictionary of organic compounds, Band 9, S. 2768 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Reinhardt B. Baudy, Lynne P. Greenblatt, Ivo L. Jirkovsky, Mary Conklin, Ralph J. Russo, Donna R. Bramlett, Tracy A. Emrey, Joanne T. Simmonds, Dianne M. Kowal: Potent quinoxaline-spaced phosphono-a-amino acids of the AP-6 type as competitive NMDA antagonists: Synthesis and biological evaluation, in: J. Med. Chem., 1993, 36 (3), S. 331–342; doi:10.1021/jm00055a004.
- ↑ a b c d J. Ehrlich, M. T. Bogert: Experiments in the veratrole and quinoxaline groups, in: J. Org. Chem., 1947, 12 (4), S. 522–534; doi:10.1021/jo01168a006.