4-Hydroxycumarin
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | 4-Hydroxycumarin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C9H6O3 | |||||||||||||||||||||
| Kurzbeschreibung |
beiges Pulver[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 162,14 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte | ||||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser, löslich in Ethanol und Dimethylformamid[3] | |||||||||||||||||||||
| Brechungsindex |
1,4500 (25 °C, 589 nm)[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
4-Hydroxycumarin als Stammverbindung der so genannten 4-Hydroxycumarine ist ein in 4-Stellung mit einer Hydroxygruppe substituiertes Cumarin. Formal liegt es als 1,2-Benzopyron bzw. 2H-Chromen-2-on vor, das auch als mit einem ungesättigten δ-Lacton-Ring anelliertes Benzol aufgefasst werden kann. Die Verbindung ist Ausgangsstoff für eine Vielzahl von pharmakologisch aktiven Wirkstoffen[4], von denen die blutgerinnungshemmenden Antikoagulantien die größte Bedeutung erlangt haben.
Vorkommen und Darstellung[Bearbeiten | Quelltext bearbeiten]
4-Hydroxycumarin entsteht in Pflanzen, wie z. B. Steinklee (Melilotus alba), die Melilotosid – das Glucosid der o-Cumarsäure (2-Hydroxyzimtsäure) – enthalten. Durch Einwirkung von Pilzen auf schimmelndes Pflanzengut bildet sich 4-HC, das mit Formaldehyd spontan zu dem blutgerinnungshemmenden Dicumarol reagiert.[5]
Biosynthese von 4-Hydroxycumarin[Bearbeiten | Quelltext bearbeiten]
Die Biosynthese des 4-Hydroxycumarins erfolgt aus den Coenzym-A-Estern der Salicylsäure (Salicyl-CoA) und der Malonsäure (Malonyl-CoA), die zu einem 1,3-Diketon reagieren, aus dem durch intramolekulare Cyclisierung das Lacton 4-HC gebildet wird.[5][6]
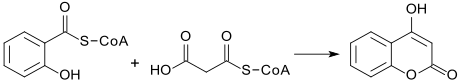
Chemische Synthese von 4-Hydroxycumarin[Bearbeiten | Quelltext bearbeiten]
Bei der Fries-Umlagerung von Phenylacetat entsteht ein Gemisch von 4-Hydroxyacetophenon (4-HAP) und 2-Hydroxyacetophenon[7] (2-HAP), wobei letzteres mit Diethylcarbonat und Natriumhydrid zu 4-Hydroxycumarin cyclisiert werden kann (Ausbeute 87 %).[8]

Die Reaktion der preisgünstigen Ausgangsstoffe Phenol und Malonsäure in Gegenwart von Zinkchlorid (ZnCl2) und Phosphoroxychlorid (POCl3) erzeugt 4-HC in brauchbaren Ausbeuten (64 %).[9]
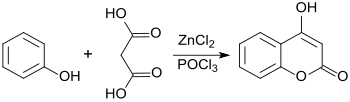
In einer Variante der Pechmann-Reaktion wird aus Phenol und Meldrumsäure – gebildet aus Malonsäure und Aceton – durch Katalyse mit dem so genannten Eaton-Reagenz 4-Hydroxycumarin in einer Gesamtausbeute von 69 % erhalten.[10]
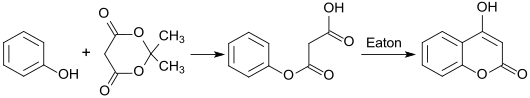
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
4-Hydroxycumarin ist ein farbloser bis gelber, geruchloser Feststoff, der in Wasser praktisch unlöslich. Im Alkalischen, in Alkoholen und organischen Lösungsmitteln, wie Chloroform, Dioxan und Dimethylsulfoxid löst sich 4-HC hingegen gut. Die Verbindung weist Keto-Enol-Tautomerie auf und liegt überwiegend als 4-Hydroxy-2-chromenon (A), neben Chromon-2,4-dion (B) vor.[11]

Anwendungen[Bearbeiten | Quelltext bearbeiten]
Die Reaktivität des 4-Hydroxycumarins – besonders ausgeprägt in der hohen Nukleophilie am C-Atom in 3-Stellung und an der enolischen Hydroxygruppe in 4-Stellung seines Chromenon-Rings – machen die Verbindung zu einem interessanten Molekülbaustein für eine Vielzahl chemischer Reaktionen. Daraus resultieren Produkte unterschiedlichster Eigenschaften und Anwendungen, von Farbstoffen bis Antitumormitteln, besonders aber Antikoagulantien zur Therapie von Blutgerinnungsstörungen und Vertilgung von Nagetieren (Rattengift).[4]
Azokupplung von 4-Hydroxycumarin mit aromatischen Diazoniumsalzen erfolgt in 3-Stellung des Chromenonrings und erzeugt Azofarbstoffe mit unterschiedlichen Absorptionsspektren,[12]
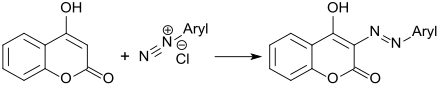
während Acylierungsprodukte mit langkettigen, ungesättigten Fettsäuren, wie z. B. 10-Undecensäure, antibakterielle Eigenschaften aufweisen.[13]

Unter Mikrowellenbestrahlung reagiert die Hydroxylgruppe in 4-Position mit Alkyl- und Acylhalogeniden in Gegenwart von Natriumhydroxid oder Kupfer/Kupfer(II)-chlorid zu O-Alkyl- bzw. O-Acylcoumarinen in Ausbeuten von 50 bis >70 %.[14]

So liefert O-Acylierung z. B. mit elektronenreichen Benzoesäuren farblose kristalline Materialien, die intensive Fluoreszenz aufweisen.[15]
Wichtigste Anwendung von 4-Hydroxycumarin ist als Baustein für gerinnungshemmende Wirkstoffe, die als so genannte Blutverdünner in der Medizin oder in der Landwirtschaft als Nagetiergifte eingesetzt werden.

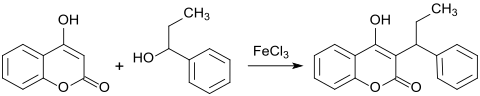
Leitverbindung ist das 1947 patentierte und nach der Patentanmelderin Wisconsin Alumni Research Foundation (WARF) benannte Warfarin.[16] Als pharmazeutische Wirkstoffe in Europa eingeführt wurden Acenocumarol und das in Deutschland am häufigsten verordnete Phenprocoumon mit dem Handelsnamen Marcumar. Aus der Arbeitsgruppe von Matthias Beller stammt eine neuere Synthesevariante, nach der aus 4-HC und 1-Phenyl-1-propanol in Gegenwart von Eisen(III)-chlorid-Hexahydrat Phenprocoumon in hoher Ausbeute (92 %) erhalten werden kann.[17]
Die wegen ihrer extremen Wirksamkeit als „Superwarfarine“ bezeichneten Nagetiergifte Bromadiolon, Brodifacoum und Flocoumafen basieren ebenfalls auf 4-Hydroxycumarin als wesentlichen Ausgangsstoff (engl. building block).
In der letzten Synthesestufe des auch bei warfarinresistenten Ratten hochwirksamen Brodifacoums wird 4-Hydroxycumarins mit einem in vierstufiger Synthese aufgebauten Oligophenylderivat zum Endprodukt umgesetzt.[18][19]

Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e Datenblatt 4-Hydroxycumarin bei Sigma-Aldrich, abgerufen am 7. Juli 2021 (PDF).
- ↑ a b Carl L. Yaws: Thermophysical Properties of Chemicals and Hydrocarbons, 2nd Edition. Elsevier Inc., Oxford, UK 2015, ISBN 978-0-323-28659-6, S. 228.
- ↑ Datenblatt 4-Hydroxycumarin, 98+% bei Alfa Aesar, abgerufen am 7. Juli 2021 (Seite nicht mehr abrufbar).
- ↑ a b M.M. Abdou, R.A. El-Saeed, S. Bondock: Review: Recent advances in 4-hydroxycoumarin chemistry. Part 1: Synthesis and seactions. In: Arabian J. Chem. Band 12, 2019, S. 88–121, doi:10.1016/arabjc.2015.06.012.
- ↑ a b B. Liu, T. Raeth, T. Beuerle, L. Beerhues: A novel 4-hydroxycoumarin biosynthetic pathway. In: Plant Mol. Biol. Band 72, 2020, S. 17, doi:10.1007/s11103-009-9548-0.
- ↑ Y. Lin, X. Shen, Q. Yuan, Y. Yan: Microbial biosynthesis of the anticoagulant precursor 4-hydroxycoumarin. In: Nat. Commun. Band 4, 2013, S. 2603, doi:10.1038/ncomms3603.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 2-Hydroxyacetophenon: CAS-Nummer: 582-24-1, EG-Nummer: 209-480-8, ECHA-InfoCard: 100.008.620, PubChem: 68490, ChemSpider: 61765, Wikidata: Q27103649.
- ↑ Patent US5696274: Syntheses based on 2-hydroxyacetophenone. Angemeldet am 22. Mai 1996, veröffentlicht am 9. Dezember 1997, Anmelder: Hoechst Celanese Corp., Erfinder: I.M. Uwaydah, M. Aslam, C.H. Brown II, S.H. Fitzhenry, J.A. McDonough.
- ↑ V. Shah, J. Bose, R. Shah: Communication – New synthesis of 4-hydroxycoumarin. In: J. Org. Chem. Band 25, Nr. 4, 1960, S. 677–678, doi:10.1021/jo01074a630.
- ↑ S.-J. Park, J.-C. Lee, K.-I. Lee: A facile synthesis of 4-hydroxycoumarin and 4-hydroxy-2-quinolinone derivatives. In: Bull. Korean Chem. Soc. Band 28, Nr. 7, 2007, S. 1203–1205, doi:10.5012/BKCS.2007.28.7.1203.
- ↑ A.O. Obaseki, W. Porter, W.F. Trager: 4-Hydroxycoumarin/2-hydroxychromone tautomerism: Infrared spectra of 2-13C and 3-D labeled 4-hydroxycoumarin and its anion. In: J. Heterocycl. Chem. Band 19, Nr. 2, 2009, S. 385–390, doi:10.1002/jhet.5570190234.
- ↑ F. Karci, N. Ertan: Synthesis of some novel heterylazo disperse dyes derived from 4-hydroxy-2H-1-benzopyran-2-one (4-hydroxycoumarin) as coupling component and investigation of their absorption spectra. In: Dyes Pigm. Band 64, Nr. 3, 2005, S. 243–249, doi:10.1016/j.dyepig.2004.06.010.
- ↑ G. Cravotto, S. Tagliapietra, R. Capello, G. Palmisano, M. Curini, M. Boccalini: Long-chain 3-acyl-4-hydroxycoumarins: Structure and antibacterial activity. In: Arch. Pharm. Band 339, Nr. 3, 2006, S. 129–132, doi:10.1002/ardp.200500127.
- ↑ A.B. Tapase, V.S. Suryawanshi, N. D. Shinde, D.B. Shinde: Solvent free microwave assisted O-alkylation and acylation of 4-hydroxy coumarin. In: Bull. Environ. Pharmacol. Life Sci. Band 1, Nr. 7, 2012, S. 597–600.
- ↑ J. Yoda, A. Djandé, L. Cissé, A. Abou, L. Kaboré, A. Saba: Review on 4-Hydroxycoumarin Chemistry: Synthesis, Acylation and Photochemical Properties. In: World J. Org. Chem. Band 7, Nr. 1, 2019, S. 19–30, doi:10.12691/wjoc-7-1-4.
- ↑ Patent US2427578: 3-Substituted 4-hydroxycoumarin and process of making it. Angemeldet am 2. April 1945, veröffentlicht am 16. September 1947, Anmelder: Wisconsin Alumni Research Foundation, Erfinder: M.A. Stahmann, M. Ikawa, K.P. Link.
- ↑ J. Kischel, K. Mertins, D. Michalik, A. Zapf, M. Beller: A general and efficient iron-catalyzed benzylation of 1,3-dicarbonyl compounds. In: Adv. Synth. Catal. Band 349, Nr. 6, 2007, S. 865–870, doi:10.1002/adsc.200600497.
- ↑ J.-C. Jung, O.S. Park: Synthetic approaches and biological activities of 4-hydroxycoumarin derivatives. In: Molecules. Band 14, 2009, S. 4790–4803, doi:10.3390/molecules14114790.
- ↑ J.-C. Jung, S. Oh: Practical synthesis of hydroxychromenes and evaluation of their biological activity. In: Molecules. Band 17, 2012, S. 240–247, doi:10.3390/molecules17010240.
