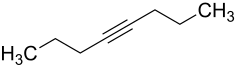
4-Octin
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 4-Octin | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C8H14 | |||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 110,20 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
0,7509 g·cm−3 (20 °C)[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
131,6 °C[2] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser[1] | |||||||||||||||
| Brechungsindex | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
4-Octin ist eine chemische Verbindung aus der Gruppe der Alkine. Sie besitzt das Grundgerüst des Octans mit einer C≡C-Dreifachbindung an der 4-Position.
4-Octin (Dipropylethin) gehört mit 5-Decin (Dibutylethin), 3-Hexin (Diethylethin) und 2-Butin (Dimethylethin) zu den symmetrischen Alkinen.
Darstellung[Bearbeiten | Quelltext bearbeiten]
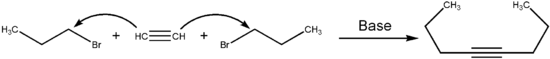
Eine Möglichkeit der Synthese von 4-Octin besteht in der Reaktion von Acetylen mit zwei Teilen 1-Brompropan. Acetylen wird hierbei mit einer Base deprotoniert. Das entstandene Anion geht dann eine Substitution an 1-Brompropan ein. Anschließend wird das zweite Kohlenstoffatom des entstandenen Alkins deprotoniert und die gleiche Reaktion läuft auf der zweiten Seite ab. Die Reaktion kann in flüssigem Ammoniak bei −70 °C mit Natriumamid als Base durchgeführt werden.[4]
Ein weiterer Syntheseweg besteht in der Eliminierung von 4,5-Dibromoctan. Als Base kann hierzu wiederum Natriumamid dienen. Die Reaktion wird bei −70 °C in flüssigem Ammoniak geführt.[5]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
4-Octin ist eine bei Raumtemperatur flüssige, farblose Verbindung, die bei 131,6 °C siedet.[2]
Verwendung[Bearbeiten | Quelltext bearbeiten]
An der Dreifachbindung von 4-Octin können eine Reihe von typischen Reaktion von Alkinen durchgeführt werden. So kann beispielsweise 2,3-Di-n-propyloxiren mittels Reaktion mit Peroxycarbonsäuren, beispielsweise Peressigsäure hergestellt werden.[6][7]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e Datenblatt 4-Octin bei Merck, abgerufen am 2. April 2017.
- ↑ a b c d e David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-406.
- ↑ E. Otsa, L. S. Kudrjawzewa, O. G. Eisen, E. M. Piotrowskaja: Thermodynamische Untersuchungen an n-Alkan/n-Alkin-Systemen, in: Monatsh. Chem., 1980, 111, S. 607–617; doi:10.1007/BF00903314.
- ↑ H. Seifert: Olefinsynthesen in der C6- bis C11-Reihe, in: Monatsh. Chem., 1948, 79, S. 198–215; doi:10.1007/BF00899394.
- ↑ H. N. Miller, K. W. Greenlee, J. M. Derfer, C. E. Boord: Mono- and Di-Alkylacetylenes from vicinal Dihalides and Sodium Amide in liquid Ammonia, in: J. Org. Chem., 1954, 19, S. 1882–1888; doi:10.1021/jo01377a003.
- ↑ M. S. Sheela, K. Sreekumar: Epoxidation and Oxidation Reactions Using Divinyl Benzene Crosslinked Polystyrene Supported t-Butyl Hydroperoxide, in: Indian J. Chem. Sect. B, 2006, 45, S. 943–950; doi:10.1002/chin.200633058.
- ↑ V. Franzen: Die Konstitution der aus Dibutylacetylen und Peressigsäure erhaltenen Verbindung C10H18O, in: Chem. Ber., 1954, 87, S. 1478–1488; doi:10.1002/cber.19540871015.
Weblinks[Bearbeiten | Quelltext bearbeiten]
- Eintrag zu 4-Octin. In: P. J. Linstrom, W. G. Mallard (Hrsg.): NIST Chemistry WebBook, NIST Standard Reference Database Number 69. National Institute of Standards and Technology, Gaithersburg MD.
- www.chemicalbook.com: 1H-NMR