Benutzer:Linksfuss/Klickeradoms
Das Haber-Bosch-Verfahren ist ein chemisches Verfahren zur Herstellung von Ammoniak aus den Elementen Stickstoff und Wasserstoff. Es ist nach seinen Entwicklern Fritz Haber und Carl Bosch benannt. Es ist das bedeutendste industrielle Verfahren zur Umwandlung des unreaktiven Luftstickstoffs in eine nutzbare Stickstoffverbindung. Ammoniak wird zur Herstellung von Kunstdünger benötigt, der Voraussetzung für die Ernährung eines Großteils der Weltbevölkerung ist. Das Haber-Bosch-Verfahren ermöglichte es auch, bei der Herstellung von Sprengstoff ohne natürliche Salpetervorkommen auszukommen.
Im Zusammenhang mit dem Haber-Bosch-Verfahren wurden mehrere Nobelpreise für Chemie vergeben: an Fritz Haber 1918 und Carl Bosch 1931 (zusammen mit Friedrich Bergius) sowie an Gerhard Ertl 2007, unter anderem für die vollständige theoretische Erklärung des Mechanismus.
Geschichte und Bedeutung[Bearbeiten | Quelltext bearbeiten]



Vor der industriellen Nutzung des Haber-Bosch-Verfahrens wurde den Ackerböden der notwendige Stickstoff für die Pflanzen in Form von Mist, Kompost oder bestimmten Fruchtfolgen zugeführt. Als sich die Landwirtschaft intensivierte, wurde Guano – der Kot unzähliger Generationen von Seevögeln auf Inseln vor der südamerikanischen Pazifikküste – abgebaut und zum einträglichen Exportgeschäft. Das Wachstum der Weltbevölkerung im 19. Jahrhundert schuf jedoch eine gewaltige Nachfrage, die nicht mehr befriedigt werden konnte. Im Juni 1898 hielt der angesehene britische Chemiker William Crookes vor der British Association for the Advancement of Science in Bristol eine aufsehenerregende Rede, in der er zum Schluss kam, dass in geschätzten 20 Jahren die Stickstoffnachfrage das Angebot übersteigen werde und dann der westlichen Welt eine gewaltige Hungersnot drohe. Die einzige Lösung sah er in der chemischen Fixierung des Luftstickstoffs.
Die durch das Haber-Bosch-Verfahren mögliche großindustrielle Herstellung von Kunstdünger machte das immense Wachstum der Weltbevölkerung im 20. Jahrhundert und damit die moderne Gesellschaft erst möglich.[1]
Die wesentlichen wissenschaftlichen Leistungen zur Realisierung dieses Verfahrens waren zum einen die Untersuchung der zugrunde liegenden chemischen Reaktion durch Fritz Haber und Walther Nernst, zum anderen die systematische Suche nach geeigneten Katalysatoren durch Alwin Mittasch. Für die technische Realisierung im großen Maßstab wurden durch Carl Bosch und Fritz Haber vollkommen neue Lösungen in vielen Bereichen der Technischen Chemie und des Reaktorbaus entwickelt. Später wurden Nobelpreise für den Chemiker Fritz Haber im Jahre 1918 und den Chemiker, Techniker und Industriellen Carl Bosch im Jahre 1931 vergeben.

Das Haber-Bosch-Verfahren wurde durch die BASF im Jahr 1910 zum Patent angemeldet, ein zuvor eingereichtes, fehlerhaftes Patent von Haber zum selben Thema wurde gleichzeitig zurückgezogen.[2] Großanlagen wurden unter anderem in Oppau bei Ludwigshafen, Leuna und Bitterfeld durch die BASF und nach Fusion im deutschen Großkonzern der I. G. Farben betrieben. Der erste zur Produktion in Oppau eingesetzte Hochdruck-Reaktor ist heute noch im Original erhalten und kann im öffentlichen Park vor dem BASF-Kasino in Ludwigshafen besichtigt werden. Die erste Ammoniak-Synthesekammer zusammen mit der zugehörigen funktionsfähigen Hochdruck-Umlaufpumpe, beide aus den Anfangsjahren der großtechnischen Ammoniaksynthese 1916/1917 im Leunawerk, befinden sich als Originale im Deutschen Chemie-Museum Merseburg auf dem Campus der Hochschule Merseburg.
Ammoniak kann beispielsweise im Ostwaldverfahren zu Salpetersäure weiterverarbeitet werden oder durch Reaktion mit Kohlenstoffdioxid (CO2) zu Harnstoff, der als Düngemittel verwendet wird.
Von militärischer Bedeutung ist Ammoniumnitrat (Salpeter), ein Produkt aus Ammoniak und Salpetersäure, zur Herstellung von Sprengstoff. Daher wurde die Weiterentwicklung des Verfahrens bis zur großindustriellen Anwendbarkeit 1914 auf Druck des deutschen Generalstabschefs Erich von Falkenhayn forciert und es kam zum Salpeterversprechen. Als das Deutsche Reich während des Ersten Weltkriegs durch die alliierte Seeblockade von natürlichen Stickstoffquellen (Chilesalpeter) abgeschnitten war, gelang es nur mit Hilfe des Haber-Bosch-Verfahrens, den sonst schon Ende 1914 drohenden Zusammenbruch der deutschen Munitionsproduktion abzuwenden und auch die Düngemittelproduktion aufrechtzuerhalten. Nach dem Krieg zwang die französische Regierung die BASF zu einem Abkommen, nach dem sie sämtliche Patente und Erfahrungen des Verfahrens zu übergeben hatte, sowie beim Aufbau einer Fabrik in Toulouse helfen musste.[3]
Die Verfügbarkeit großer Mengen an Stickstoffdünger gab Anlass für umfangreiche landwirtschaftliche Forschungen, in denen die verwendeten Düngermengen je nach Boden und Pflanzenart optimiert wurden (Minimum-Tonne). Durch großflächigen Düngemitteleinsatz konnte die weltweite landwirtschaftliche Produktion deutlich gesteigert werden.
Nach diesem Verfahren wird mit 100 Millionen Tonnen der Großteil des jährlich produzierten Ammoniaks erzeugt. Aufgrund des hohen Energiebedarfs bei der Herstellung des benötigten reinen Wasserstoffs entfallen etwa 1,4 % des Weltenergieverbrauchs auf das Haber-Bosch-Verfahren.
Harnstoff ist auch für den Umweltschutz von Bedeutung: Die in Verbrennungsgasen enthaltenen schädlichen Stickoxide lassen sich mit Harnstoff über Selektive nichtkatalytische Reduktion und Selektive katalytische Reduktion zu unschädlichem Stickstoff reduzieren.
Heutzutage hat, zumindest bei der Bevölkerung der Industrienationen, ca. 40 % des im menschlichen Körper enthaltenen Stickstoffs schon einmal an der Haber-Bosch-Synthese teilgenommen.
Rohstoffe[Bearbeiten | Quelltext bearbeiten]
Ammoniak entsteht in einer Gleichgewichtsreaktion aus den Elementen Wasserstoff und Stickstoff. Hierzu werden benötigt:
- aus der Luft
- aus Methangas () und Wasserdampf
Spaltgaserzeugung[Bearbeiten | Quelltext bearbeiten]
Im ersten Schritt wird Wasserstoff vom Kohlenstoff getrennt. Dazu lässt man Methan mit Wasserdampf, mit Hilfe eines Katalysators (Nickeloxid-Aluminiumoxid-Katalysator), zu Kohlenstoffmonoxid und Wasserstoff reagieren (Primärreformer).
Sekundärreformer[Bearbeiten | Quelltext bearbeiten]
Da die obige Reaktion das Methangas nur unvollkommen umsetzt, lässt man in einem zweiten Schritt das restliche Methangas mit Sauerstoff zu Kohlenstoffmonoxid und Wasserstoff reagieren (Sekundärreformer). Der Sekundärreformer wird hierzu mit Luft beschickt, wobei der für die spätere Ammoniaksynthese erforderliche Stickstoff automatisch in das Gasgemisch kommt.
Konvertieren (Oxidieren) des Kohlenstoffmonoxids zu Kohlenstoffdioxid[Bearbeiten | Quelltext bearbeiten]
In einem dritten Schritt muss das Kohlenstoffmonoxid zu Kohlenstoffdioxid oxidieren, was als Konvertierung bzw. Wassergas-Shift-Reaktion bezeichnet wird.
Kohlenstoffmonoxid und Kohlenstoffdioxid bilden mit Ammoniak Feststoffe (Carbamate), die in kurzer Zeit Rohrleitungen und Apparate verstopfen würden. Im folgenden Prozessschritt muss daher das Kohlenstoffdioxid aus dem Gasgemisch entfernt werden.
Absorption von Kohlenstoffdioxid (Gaswäsche)[Bearbeiten | Quelltext bearbeiten]
Im Gegensatz zu Kohlenstoffmonoxid kann Kohlenstoffdioxid durch eine Gaswäsche leicht aus dem Gasgemisch entfernt werden. Kohlenstoffdioxid wird durch Waschen mit Triethanolamin aus dem Gemisch entfernt.
Verfahren[Bearbeiten | Quelltext bearbeiten]
Im letzten Schritt wird das Wasserstoff-Stickstoff-Gemisch bei Hochdruck und etwa 450 °C katalytisch zu Ammoniakgas gemäß der folgenden Formel umgesetzt:
Das Haber-Bosch-Verfahren wird industriell in großen Anlagen angewendet, um preiswert Ammoniak zu gewinnen.
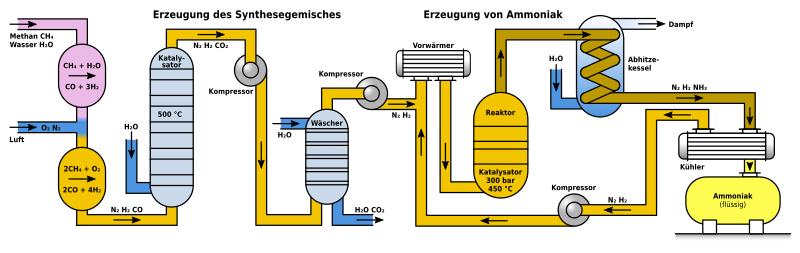 Das Schema zeigt den Aufbau einer solchen Anlage und ist von links nach rechts zu lesen:
Das Schema zeigt den Aufbau einer solchen Anlage und ist von links nach rechts zu lesen:
- Links oben wird Methan und Wasserdampf in den sogenannten Primärreformer eingeleitet, dort entsteht bereits ein Teil des Wasserstoffes.
- Links mittig wird Luft eingeleitet, die zu 21 Prozentteilen aus Sauerstoff und 79 Prozentteilen aus Stickstoff besteht. Durch den Luftsauerstoff entsteht weiterer Wasserstoff.
- Das im entstandenen Gemisch enthaltene Kohlenmonoxid wird in dem ersten grau-blau gezeichneten Reaktor mit Wasserdampf in Gegenwart eines Katalysators zu Kohlendioxid umgesetzt.
- Im Waschturm reagiert das Kohlendioxid unter Druck mit Calciumhydroxid in wässriger Lösung und wird so von den gewünschten gasförmigen Reaktionsedukten Wasserstoff und Stickstoff getrennt und es entsteht Calciumcarbonat (eine andere mögliche Waschflüssigkeit ist z. B. Triethanolamin).
- Anschließend werden die Reaktionsedukte auf die Zustände im eigentlichen Reaktionsreaktor vorbereitet, in dem sie auf 450 °C hochgeheizt und auf 300 bar komprimiert werden.
- Im mittig gezeichneten Reaktionsreaktor findet die eigentliche Herstellung von Ammoniak statt.
- Die Reaktionsprodukte werden für eine maximale Ausbeute laufend entfernt. Sie werden von 450 °C heruntergekühlt und das erzeugte Ammoniak kondensiert aus. Die noch nicht reagierten Produkte Stickstoff und Wasserstoff werden, um das Frischgas ergänzt, im Kreislauf wieder dem Reaktor zugeführt.
Synthesebedingungen[Bearbeiten | Quelltext bearbeiten]
| Temperatur (°C) | Keq |
|---|---|
| 300 | 4,34 × 10−3 |
| 400 | 1,64 × 10−4 |
| 450 | 4,51 × 10−5 |
| 500 | 1,45 × 10−5 |
| 550 | 5,38 × 10−6 |
| 600 | 2,25 × 10−6 |
Beim Haber-Bosch-Verfahren wird ein Gasgemisch aus Wasserstoff und Stickstoff an einem Eisenoxid-Mischkatalysator aus Eisen(II/III)-Oxid (Fe3O4), K2O, CaO, Al2O3 und SiO2 bei etwa 300 bar Druck und 450 °C zur Reaktion gebracht:
Der eigentliche Katalysator α-Fe (Ferrit) entsteht erst im Reaktor durch die Reduktion von Fe3O4 mit Wasserstoff.

Die Ammoniaksynthese findet heute unter folgenden Reaktionsparametern statt:[5]
- Mengenverhältnis Stickstoff zu Wasserstoff = 1 : 3
- Druck: 250 bar bis 350 bar
- Temperatur: 450 °C bis 550 °C (der Zerfall des Ammoniaks und die Wirksamkeit des Katalysators steigen mit der Temperatur an; hier liegt das Optimum)
- Verwendung von α-Eisen als Katalysator, welches durch Reduktion aus Eisen(II/III)-Oxid (Fe3O4), K2O, CaO, Al2O3 und SiO2 als Promotoren gewonnen wird.
Durch den Katalysator wird die Aktivierungsbarriere für die Spaltung der Dreifachbindung des Stickstoffmoleküls zwar stark abgesenkt, dennoch sind immer noch hohe Temperaturen für eine angemessene Reaktionsgeschwindigkeit erforderlich. Weil die Gesamtreaktion exotherm ist (Bildung von 2 NH3: ΔH0= −92,5 kJ/mol) führt die hohe Temperatur zu einer Verschiebung des Gleichgewichts zu den Edukten (Ausgangsstoffen) und verringert deshalb die Ausbeute (Prinzip von Le Chatelier). Da die Reaktion unter Volumenverminderung abläuft, führt der hohe Arbeitsdruck zu einer Erhöhung der Ausbeute. Zudem entfernt man das gebildete Ammoniak laufend aus dem Reaktionssystem.
Der Volumenanteil NH3 im Gasgemisch beträgt rund 17,6 %.
Der für die Reaktion nötige Wasserstoff wird heute meist durch die partielle Oxidation von Erdgas erschlossen, der Stickstoff wird wie schon im ursprünglichen Verfahren direkt aus der Luft entnommen. Der störende Luft-Sauerstoff wurde früher durch Reduktion mit Wasserstoff zu Wasser umgesetzt und so abgeschieden. Inzwischen ist die Luftzerlegung durch Fraktionierung von flüssiger Luft wirtschaftlicher.
Moderne Ammoniakanlagen erzeugen mehr als 3.000 Tonnen pro Tag in einer Produktionslinie.
Katalysator[Bearbeiten | Quelltext bearbeiten]
Der Katalysator-Präcursor besteht aus Magnetit (Fe3O4) und oxidischen Promotoren. Dieser wird (meist durch Synthesegas) zum eigentlichen Katalysator aus α-Eisen reduziert. Der Präcursor wird in einem Schmelzprozess (Magnetit mit Promotoren) hergestellt. Der Vorteil des Schmelzverfahrens gegenüber alternativen Verfahren (Oxidation von reinem Eisen) ergibt sich daraus, dass Magnetit über 100 °C die thermodynamisch stabilste Eisenoxidphase ist. Dies ist vorteilhaft, da aus Magnetit als Präcursor besonders effektive Katalysatoren gebildet werden. Die Rohmaterialien sollten frei von Katalysatorgiften sein. Die Promotoren sollten in der Magnetit-Schmelze homogen verteilt sein, dies wird durch ein anfängliches Erhitzen der Mischung auf über 3500 °C erreicht. Ein weiterer Faktor bei der Produktion ist die Abkühlrate der Schmelze. Schnelleres Abkühlen führt zu Katalysatoren besserer Qualität, die jedoch weniger Abrieb-Resistent sind; es wird in der Praxis bevorzugt.[6]
Reduktion des Katalysators[Bearbeiten | Quelltext bearbeiten]
Die Reduktion wird mit Synthesegas durchgeführt, man erhält aus dem Magnetit eine hochporöse, katalytisch sehr aktive Form des alpha-Eisens. Die Promotoren werden nicht reduziert (außer Cobalt). Für eine optimale Katalysatorqualität muss die Reduktion in einer bestimmten Weise durchgeführt werden. Der Dampfdruck des bei der Reduktion entstehenden Wassers muss im Gasgemisch möglichst gering gehalten werden (unter 3 g·m−3). Kommt Wasserdampf in Kontakt mit bereits reduziertem Katalysator, führt das speziell in Verbindung mit hohen Temperaturen zu vorzeitiger Alterung des Katalysators durch Rekristallisation. Die Reduktion wird daher bei hohem Gasaustausch, geringem Druck und kleinstmöglichen Temperaturen durchgeführt. In der Praxis wird die Reduktion des Katalysators direkt in der Produktionsanlage durchgeführt. Die exotherme Reaktion des Ammoniaks wird für eine schrittweise Erhöhung der Temperatur genutzt.[6]
Die Reduktion von frischem, komplett oxidierten Katalysator (bzw. Precursor) bis zum Erreichen der vollen Kapazität dauert dann 4–10 Tage.[6] Die FeO-Phase (Wüstit) wird schneller und bei geringeren Temperaturen reduziert, als die Fe2O3-Phase (Magnetit). Nach detaillierten kinetischen, mikroskopischen und röntgenspektroskopischen Untersuchungen wurde für die Reduktion das folgende Modell entwickelt:
- FeO (Wüstit) wird zu Beginn zu metallischem Eisen umgesetzt
- Diese Reaktion führt zu einem Gradient an Eisen(II)ionen. Wegen dieses Gradienten diffundieren Eisen(II)ionen rasch vom Fe2O3 durch das FeO an die Grenzfläche, wo sie als Eisenkeime ausfallen. Die Diffusion wird durch Defekte im FeO ermöglicht. Die Reduktion von Fe3+ zu Fe2+ an der Magnetit-Wustit-Grenzfläche wird nicht durch direkten Kontakt mit Wasserstoff, sondern durch Ionen- und Elektronen-Diffusion verursacht:
Dieser Prozess führt dann zu einer Kern-Schale-Struktur.
In der Praxis haben vorreduzierte, stabilisierte Katalysatoren (prereduced, stabilized catalyst types) einen bedeutenden Marktanteil errungen. Dies sind Katalysatoren, die bereits die volle Porenstruktur des normalen Katalysators durch Reduktion bekommen haben, wie ein aktiver Katalysator, dann jedoch noch einmal oberflächlich oxidiert wurden. Durch diese Oxidation sind sie nicht mehr pyrophor, wie es die reduzierten Katalysatoren sonst sind. Das Reaktivieren solcher vorreduzierter Katalysatoren benötigt nur 30–40 Stunden. Neben der geringen Anlaufzeit besitzen solche Katalysatoren noch weitere Vorteile, wie ein geringeres Risiko, den Katalysator durch Wasser zu beschädigen und ein geringeres Gewicht.[6]
Katalysatorgifte[Bearbeiten | Quelltext bearbeiten]
Katalysatorgifte reduzieren die Aktivität des Katalysators. Diese Substanzen sind entweder Bestandteil des Synthesegases oder stammen aus Verunreinigungen aus dem Katalysator selbst. Zweiteres spielt keine größere Rolle. H2O, CO, CO2 und O2 sind temporäre Katalysatorgifte. Schwefel-, Phosphor-, Arsen- und Chlor-Verbindungen sind permanente Katalysatorgifte.[6]
Andere Katalysatoren als Eisen[Bearbeiten | Quelltext bearbeiten]
Die meisten Anstrengungen zur Verbesserung des industriellen Verfahrens zur Synthese von Ammoniak flossen in die Synthesegas-Produktion und führten dort zu bedeutenden Fortschritten. Bei der Verbesserung des Katalysators zur Ammoniak-Synthese hingegen hat es seit den 1920ern keine bedeutenden Fortschritte mehr gegeben. Der Eisenkatalysator benötigt noch immer einen hohen Druck (wenigstens 130 bar), hohe Temperaturen (400–500 °C) und große Volumen (Reaktor von wenigstens 100 m³ für eine Produktionskapazität von 1800 t/d). Nach theoretischen und praktischen Studien ist der Spielraum für weitere Verbesserungen des Eisenkatalysators begrenzt. Die theoretischen Möglichkeiten zur Energieersparnis sind hingegen gewaltig; wenn der Druck auf das Niveau der Synthesegas-Produktion gesenkt werden könnte, könnte ungefähr 1 GJ/t Ammoniak eingespart werden.[6]
Auf der Suche nach alternativen Katalysatoren wurden die meisten Metalle bereits intensiv getestet. Eine große Verbesserung brachte eine Modifizierung des Eisenkatalysators durch Cobalt um 1984. Das einzig andere, vielversprechende Element ist heute Ruthenium.[6] Eisen wurde aufgrund des Preises, der Verfügbarkeit, der einfachen Verarbeitung, der Lebensspanne des Katalysators und der Aktivität ausgewählt. Haber selbst wollte zunächst Osmium und Uran als Katalysatoren verwenden. Der Vulcono-Plot zeigt eine gute Aktivität für beide Metalle. Uran reagiert jedoch während der Katalyse zum Nitrid, Osmiumoxid ist flüchtig und hochgiftig, was ein Problem bei der Katalysatorherstellung ist.[7] Man erkennt im Vulcano-Plot ein Optimum für Metalle der Gruppe 8 (Eisengruppe). Ein katalytisch aktives Element muss den Stickstoff auf der einen Seite dissoziativ adsorbieren, auf der anderen Seite aber nicht zu stark binden, da es sonst zu self-poisoning kommt. Die Metalle links der Eisengruppe zeigen eine zu starke Bindung zu Stickstoff und vergiften sich selbst durch eine Bildung von Volumen- oder Oberflächennitriden. Metalle rechts der Eisengruppe bilden keine Bindung zu Stickstoff aus und erleichtern somit auch nicht die Dissoziation. Nach mit der Adsorptionsenthalpie, der Bindungsenergie des adsorbierten Atoms DM (570 kJ·mol−1) und der Dissoziationsenergie für Stickstoff ergibt 200 kJ·mol−1. Eisen besitzt eine gute Balance zwischen beiden thermodynamischen Größen.[7]
Ruthenium-Katalysatoren werden als Katalysatoren der zweiten Generation bezeichnet, da sie bei vergleichbaren Drücken und niedrigeren Temperaturen eine höhere Aktivität zeigen. Die Aktivität des Ruthenium-Katalysators ist stark vom Support und den Promotoren abhängig. Als Promotoren kommen eine Vielzahl an Substanzen infrage, neben Kohlenstoff sind dies MgO, Al2O3, Zeolite, MgAl2O4 und BN.[8] Ru/C wird bereits seit 1992 industriell im „KBR Advanced Ammonia Process“ (KAAP, dt. etwa moderner/weiterentwickelter Ammoniak-Prozess nach Kellogg, Brown und Root) verwendet.[9] Problematisch ist dabei, dass der Kohlenstoff-Support zu Methan reagiert und so abgebaut wird, was die Lebensspanne des Katalysators reduziert. Um das Problem der der Methanisierung zu mildern, wird der Kohlenstoff zuvor bei 1500 °C behandelt. Außerdem geht von dem fein dispergierten Kohlenstoff eine Explosionsgefahr aus. Bisher hat sich Magnesiumoxid (MgO) als beste Alternative erwiesen, besonders aufgrund der niedrigen Acidität. Generell ist Ruthenium auf möglichst basischem Support am reaktivsten. Aufgrund der geringen strukturellen Stabilität wird MgO aber nicht in der Industrie verwendet. Ein Support mit aciden Eigenschaften ist generell nicht zu verwenden, da er dem Ruthenium verfügbare Elektronen entzieht. Die Suchen nach einem passenden Support wird daher fortgesetzt.[8]
So wie bei jedem Katalysator ist auch bei Ruthenium der geschwindigkeitsbestimmende Schritt die N2-Dissoziation. Das aktive Zentrum ist hierfür bei Ruthenium eine sogenannte B5-Stelle (B5 site), einer 5-fach koordinierte Position an der Ru(0001)-Oberfläche, an der zwei Ru-Atome eine Stufenkante mit drei Ru-Atome der Ru(0001)-Oberfläche bilden. Die Zahl an B5-Stelle ist abhängig von Größe und Form der Ruthenium-Partikel, dem Ruthenium-Precursor und der verwendeten Menge an Ruthenium.[8] Die verstärkende Wirkung des basischen Supports hat die gleiche Wirkung wie der Promotoreffekt von Alkalimetallen, der hier ebenso wie beim Eisenkatalysator zum Tragen kommt.[8]
Produkte[Bearbeiten | Quelltext bearbeiten]
Ammoniak wird im großen Maßstab zu weiteren Produkten wie Harnstoff, Blausäure und Salpetersäure weiterverarbeitet. Die Salpetersäure selbst ist Grundstoff für Endprodukte wie Düngemitteln und Sprengstoffen. Blausäure wird weiter zu Nitrilen verarbeitet und in der Herstellung von Kunststoffen verwandt.
Mechanismus der Reaktion[Bearbeiten | Quelltext bearbeiten]
Die Reaktion kann, wie jede heterogen katalysierte Reaktion, in die folgenden fünf Schritte eingeteilt werden:
- Transport der Edukte aus der Gasphase durch die Grenzschicht an die Oberfläche des Katalysator-Partikels in das Porensystem an die Porenwand
- Adsorption des Reaktanten
- Reaktion
- Desorption
- Rücktransport ins Gasvolumen.
Bei IR-Untersuchungen wurden NH- und NH2-Spezies auf der Oberfläche gefunden. Lässt man Stickstoff bei tiefen Temperaturen auf eine Oberfläche adsorbieren, physisorbiert der Stickstoff zunächst und dissoziiert (chemisorbiert) erst, wenn die Temperatur erhöht wird. Ebenso durchläuft der Stickstoff auch bei hohen Temperaturen erst die Physisorption und anschließend die Chemisorption. Aus anderen Untersuchungen ist bekannt, dass der geschwindigkeitsbestimmende Schritt der Reaktion die Dissoziation des Stickstoffs ist.[6]

Auf Basis dieser experimentellen Befunde kann ein Reaktionsschema erstellt werden, das aus den folgenden Einzelschritten besteht:
- H2 + * ⇌ 2 Had
- N2 + * ⇌N2,ad
- N2,ad⇌ 2 Nad
- Nad + Had ⇌ NHad
- NHad + Had ⇌ NH2,ad
- NH2,ad + Had ⇌ NH3,ad
- NH3,ad ⇌ NH3 + *
Stickstoff bildet auf der Eisenoberfläche unter dissoziativer Adsorption ein Oberflächen-Nitrid (Nads); das Oberflächen-Nitrid kann als ein Komplex aus Eisenoberfläche und Stickstoffatom verstanden werden. Daran addieren sich schnell Wasserstoffatome (Hads); diese sind auf der Oberfläche sehr beweglich. Es bilden sich Oberflächenimide (NHad), Oberflächenamide (NH2,ad) und Oberflächen-Ammoniakate (NH3,ad), letztere zerfallen unter NH3-Abgabe (Desorption).[10]

Mit dem Wissen um die Reaktionsenthalpie der einzelnen Schritte kann ein Energiediagramm erstellt werden. Mit Hilfe des Energiediagramms lassen sich homogene und heterogene Reaktion vergleichen: Aufgrund der hohen Aktivierungsenergie der Dissoziation von Stickstoff ist die homogene Gasphasenreaktion nicht durchführbar. Der Katalysator umgeht dieses Problem, da der Energiegewinn, der aus der Bindung von Stickstoffatomen an die Katalysatoroberfläche resultiert, die notwendige Dissoziationsenergie überkompensiert, sodass die Reaktion schlussendlich sogar exotherm ist. Trotzdem bleibt die dissoziative Adsorption von Stickstoff der geschwindigkeitsbestimmende Schritt: nicht wegen der Aktivierungsenergie, sondern vor allem aufgrund des ungünstigen präexponentiellen Faktors der Geschwindigkeitskonstante. Die Hydrierung ist zwar endotherm, diese Energie kann jedoch leicht von der Reaktionstemperatur (ca. 700 K) aufgebracht werden.[6]
Die Adsorption von N2 ähnelt der Chemisorption von CO. Da er isoelektronisch zu CO ist, adsorbiert er in der On-end-Konfiguration M-N-N.[11][12] Ab-initio-MO-Rechnungen haben gezeigt, dass neben der σ-Hinbindung zum Metall eine π-Rückbindung aus den d-Orbitalen des Metalls in die π*-Orbitale des Stickstoffs vorliegt. Die dadurch resultierende Bindungsschwächung konnte durch eine Verringerung der Wellenzahlen im Vergleich zur Gasphase der N2-Streckschwingung experimentell belegt werden.[12]
Die dissoziative Adsorption des Stickstoffs auf der Oberfläche kann noch genauer betrachtet werden:
N2 → S*–N2 (γ-state) → S*–N2–S* (α-state) → 2 S*–N (β-state)
Die molekulare Adsorption (Physisorption) von N2 geht der dissoziativen Adsorption zunächst voraus. Die einzelnen Moleküle wurden mit Röntgenphotoelektronenspektroskopie (XPS), Hochauflösende Elektronenenergieverlustspektroskopie (HREELS) und IR-Spektroskopie identifiziert bzw. zugeordnet. Auf einer Fe(111)-Oberfläche führt die Adsorption von N2 zunächst zu einer adsorbierten γ-Spezies mit einer Adsorptions-Energie von 24 kJ·mol−1 und einer N-N-Streckschwingung von 2100 cm−1. Zusammen mit Ergebnissen aus der Photoelektronenspektroskopie ergibt sich ein Bild von N2-Molekülen, die senkrecht zur Oberfläche adsorbiert sind.[6][13] Der Stickstoff im α-Zustand ist mit 31 kJ·mol−1 stärker gebunden. Die N-N-Streckschwingung sinkt auf 1490 cm−1, was eine Reduzierung der Bindungsordnung anzeigt. Ein Vergleich mit Schwingungsspektren von Komplexverbindungen lässt den Schluss zu, dass das N2-Molekül „side-on“ gebunden ist, mit einem N-Atom in Kontakt zu einer C7-site. Die Verlängerung bzw. Schwächung der N-N-Bindung basiert auf einer π-Rückbindung, die Elektronendichte in die antibindenden Orbitale des Stickstoffs einbringt. Ein weiteres Aufwärmen der Fe(111)-Oberfläche, die von α-N2 bedeckt ist, führt sowohl zu Desorption als auch zum Auftauchen einer neuen Bande bei 450 cm1. Diese stellt eine Metall-N-Schwingung dar, den β-Zustand. Diese Struktur wird häufig (auch hier, oben) als „Oberflächennitrid“ bezeichnet. Das Oberflächennitrid ist sehr stark an die Oberfläche gebunden, es desorbiert erst (in Zusammenhang mit Rekombination) bei etwa 700 K.[13]
Eisen weist zudem verschiedene Kristallflächen auf. Die Reaktivität der Kristallflächen ist höchst unterschiedlich. Die (111)- und (211)-Flächen weisen die mit Abstand höchste Aktivität auf. Eine Erklärung dafür ist, dass nur diese beiden Flächen C7-Sites aufweisen – Eisenatome mit sieben nächsten Nachbarn. Es gibt auch theoretische Begründungen dafür, warum die C7-Sites eine besondere Aktivität aufweisen.[6]
Alternative Verfahren[Bearbeiten | Quelltext bearbeiten]
Das oben beschriebene Steamreforming-Verfahren zur Gewinnung von Synthesegas ist das am häufigsten angewendete. Andere mögliche Verfahren sind:
Partielle Oxidation[Bearbeiten | Quelltext bearbeiten]
Dabei werden Steinkohle oder Kohlenwasserstoffe mit Sauerstoff und Wasserdampf in einem offenen Reaktor ohne Katalysator bei ca. 1100 °C vergast und das Synthesegas wie beim Steamreforming weiterverarbeitet. Stickstoff wird vor Eintritt in die Ammoniaksynthese in stöchiometrischer Menge zudosiert.
Elektrolyse von Wasser[Bearbeiten | Quelltext bearbeiten]
Hierdurch wird mit hohem Aufwand an elektrischer Energie Wasser in Wasserstoff (H2) und Sauerstoff (O2) zerlegt. Stickstoff wird dem so gewonnenen Wasserstoff in stöchiometrischer Menge zudosiert. Dieses Verfahren ist nur wirtschaftlich, wenn billige elektrische Energie z. B. aus Wasserkraft zur Verfügung steht, für die es keine andere Verwendung gibt.
Solid State Ammonia Synthesis[Bearbeiten | Quelltext bearbeiten]
Direkte elektrolytische Synthese von Ammoniak aus Wasser und Stickstoff unter Einsatz von Strom. Der Umweg über Wasserstofferzeugung aus Wasser wird nicht gegangen. Der Wirkungsgrad ist dadurch höher. Da Ammoniak ein energiereicher Stoff ist, wird jedoch immer noch sehr viel Strom benötigt. Dieses Verfahren ist daher ebenfalls nur wirtschaftlich, wenn sehr billige elektrische Energie zur Verfügung steht.
Wassergaserzeugung[Bearbeiten | Quelltext bearbeiten]
Wasserstoff wird über die Reaktion von Wasserdampf mit glühendem Koks (siehe Wassergas) hergestellt. Dabei wird Luft zugeführt, jedoch nur soviel, dass der Sauerstoff vollständig verbraucht wird, wobei Kohlenstoffmonoxid entsteht. Der für die spätere Ammoniaksynthese erforderliche Stickstoff verbleibt im Wassergas. Anschließend wird das Kohlenstoffmonoxid wie bereits oben beschrieben mittels Konvertierung in leicht zu entfernendes Kohlenstoffdioxid umgewandelt. Dieses Verfahren hat nur noch historische Bedeutung.
Literatur[Bearbeiten | Quelltext bearbeiten]
- Gerhard Ertl: Elementarschritte bei der heterogenen Katalyse. In: Angewandte Chemie. 102, Nr. 11, 1990, ISSN 0044-8249, S. 1258–1266, doi:10.1002/ange.19901021108.
- Sandro Fehr: Die „Stickstofffrage“ in der deutschen Kriegswirtschaft des Ersten Weltkriegs und die Rolle der neutralen Schweiz. Nordhausen 2009, DNB 993295185.
- Alwin Mittasch: Geschichte der Ammoniaksynthese. Verlag Chemie, Weinheim 1951, DNB 453395902.
- Robert Schlögl: Katalytische Ammoniaksynthese – eine „unendliche Geschichte“? In: Angewandte Chemie. 115, Nr. 18, 2003, ISSN 0044-8249, S. 2050–2055, doi:10.1002/ange.200301553.
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Jörg Albrecht: 100 Jahre Haber-Bosch-Verfahren, Brot und Kriege aus der Luft. In: Frankfurter Allgemeine Zeitung. 14. Oktober 2008, abgerufen am 24. Februar 2012.
- ↑ Patent DE235421: Verfahren zur synthetischen Darstellung von Ammoniak aus den Elementen. Veröffentlicht am 13. Oktober 1908.
- ↑ Harm G. Schröter: Das internationale Stickstoffkartell 1929–1939. In: Harm G. Schröter, Clemens A. Wurm (Hrsg.): Politik, Wirtschaft und internationale Beziehungen, Studien zu ihrem Verhältnis in der Zeit zwischen den Weltkriegen. Mainz 1991, S. 129 f.
- ↑ Theodore L Brown; H Eugene LeMay; Bruce Edward Bursten; Linda Sue Brunauer (Hrsg.): Chemistry the Central Science. 9. Auflage. Prentice Hall, Upper Saddle River, NJ 2003, ISBN 0-13-038168-3.
- ↑ Fokus Chemie Oberstufe Einführungsphase. Cornelsen-Verlag, Berlin 2010, ISBN 978-3-06-013953-8, S. 79.
- ↑ a b c d e f g h i j k Max Appl: Ammonia. Principles and industrial practice. Wiley-VCH, Weinheim u. a. 1999, ISBN 3-527-29593-3, S. 17–64 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Michael Bowker: Promotion in Ammonia Synthesis. In: D. A. King, D. P. Woodruff (Hrsg.): The Chemical Physics of Solid Surfaces. Volume 6 Coadsorption, promoters and poisons.. Elsevier, 1993, ISBN 0-444-81468-X, Chapter 7, S. 225–268.
- ↑ a b c d Zhixiong You, Koji Inazu, Ken-ichi Aika, Toshihide BabaCorresponding: Electronic and structural promotion of barium hexaaluminate as a ruthenium catalyst support for ammonia synthesis. In: Journal of Catalysis. Band 251, Nr. 2, Oktober 2007, doi:10.1016/j.jcat.2007.08.006.
- ↑ F. Rosowski, A. Hornung, O. Hinrichsen, D. Herein, M. Muhler: Ruthenium catalysts for ammonia synthesis at high pressures: Preparation, characterization, and power-law kinetics. In: Applied Catalysis A: General. Band 151, Nr. 2, April 1997, doi:10.1016/S0926-860X(96)00304-3.
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 662.
- ↑ Gerhard Ertl, S. B. Lee, M. Weiss: Kinetics of nitrogen adsorption on Fe(111). doi:10.1016/0039-6028(82)90702-6.
- ↑ a b S. B. Lee, M. Weiss: Adsorption of nitrogen on potassium promoted Fe(111) and (100) surfaces. In: Surface Science. Band 114, Nr. 2–3, Februar 1982, S. 527–545, doi:10.1016/0039-6028(82)90703-8.
- ↑ a b Gerhard Ertl: Reactions at Solid Surfaces. John Wiley & Sons, 2010, ISBN 978-0-470-26101-9, S. 123 (englisch, eingeschränkte Vorschau in der Google-Buchsuche).










