Benutzer:Stolze Rose/Spielwiese/Wallach-Umlagerung
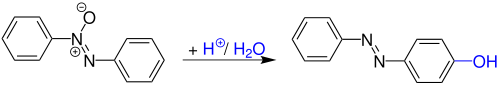
Die Wallach-Umlagerung, auch Wallach-Transformation genannt, ist eine Namensreaktion der organischen Chemie und wurde 1880 von Otto Wallach und L. Belli entdeckt. Es handelt sich hierbei um eine säurekatalytische Umlagerung von Azoxybenzolen zu Hydroxyazobenzolen.[1][2]
Übersichtsreaktion[Bearbeiten | Quelltext bearbeiten]
Otto Wallach und L. Belli entdeckten die Reaktion, als sie Azobenzol durch leichtes erwärmen in konzentrierter Schwefelsäure lösten. Nach der Verdünnung mit Wasser, fielen granatrote, metallisch schillernde Pyramiden aus.[3]
Die Benzidin-Umlagerung ist der Wallach-Umlagerung sehr ähnlich. Allerdings werden für die Wallach-Umlagerung starke Säuren verwendet, wohingegen bei der Benzidin-Umlagerung schwache Säuren genügen. Aufgrund der höheren Wasserstoff-Ionen Konzentration in starken Säuren können beide Stickstoff-Atome protoniert werden. Kinetische Studien haben bewiesen, dass nach der Monoprotonierung die Umlagerungsrate steigt, dies deutet auf ein dikationisches Zwischenprodukt hin. Weitere kinetische Studien zeigten, dass es je nach Konzentration der Säure ein unterschiedliches Zwischenprodukt gebildet wird. Bei bis zu 75%iger Schwefelsäure entsteht ein Chinolin-Zwischenrpodukt. Ab 80%iger Schwefelsäure entsteht ein dikationisches Zwischenprodukt. Wenn die Konzentration zwischen 75% und 80% liegt sind beide Intermediate möglich.
Mechanismus[Bearbeiten | Quelltext bearbeiten]
Ein möglicher Mechanismus wurde von Zerong Wang im Buch Comprehensive Organic Name Reactions and Reagents formuliert. Hierbei wird der Weg über dikationische Zwischenprodukte gezeigt:

Die Wallach-Umlagerung beginnt damit, dass zwei Wasserstoff-Ionen an das Azoxybenzol (1) gelagert werden. Das erste lagert sich an das negativ geladene Sauerstoff-Atom des Edukts. Ein weiteres lagert sich an das Stickstoff-Atom ohne gebundenen Sauerstoff. Durch Wasserabspaltung bildet sich das Dikation 2 mit zwei mesomeren Grenzstrukturen. Ein Phenylring wird dabei entaromatisiert, es entsteht ein 1,4-chinoides System. Im nächsten Schritt lagert sich Wasser unter Bildung des Oxoniumions 3 an. Da dieses instabil ist, spaltet sich ein Proton ab. Durch die Abspaltung eines weiteren Protons wird der zweite Sechsing wieder aromatisiert und es entsteht das gewünschte Endprodukt, das Hydroxyazobenzol (4).
Anwendung[Bearbeiten | Quelltext bearbeiten]
Diese Reaktion findet vor allem eine Anwendung bei der Herstellung von Hydroxyazobenzol und Hydroxyazonaphtalin. Diese Stoffe werden dazu verwendet Seifen, Lacke, Fette und Harze einzufärben.
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Zerong Wang: Comprehensive Organic Name Reactions and Reagents. John Wiley & Sons, New Jersey 2009, ISBN 978-0-471-70450-8, S. 2942 – 2945.
- ↑ M. Windholz: The Merck Index. Merck&Co., Rakway 1976, ISBN 911910263(?!), S. ONR-92.
- ↑ O. Wallach, L. Belli: Über die Umwandlung von Azoxybenzol in Oxazobenzol. In: Chem. Ber. Band 13, '''1880''', S. 525–527.doi:10.1002/cber.188001301153