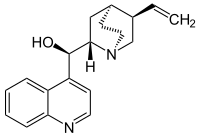
Cinchonidin
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Cinchonidin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C19H22N2O | ||||||||||||||||||
| Kurzbeschreibung |
farbloser, kristalliner Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 294,39 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
schlecht in Wasser (0,25 g·l−1 bei 20 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Cinchonidin gehört zur Gruppe der China-Alkaloide. Es ist – wie die meisten Alkaloide – physiologisch aktiv und ist ein Pflanzengift.[4]
Vorkommen[Bearbeiten | Quelltext bearbeiten]
(–)-Cinchonidin und das Isomer (+)-Cinchonin kommen in der Natur in der Rinde von Chinarindenbäumen (hauptsächlich Cinchona spp, Cinchona pubescens und Cinchona ledgeriana)[5][6] vor und können daraus extrahiert werden.

Chemische Eigenschaften und Verwendung[Bearbeiten | Quelltext bearbeiten]
Cinchonidin kristallisiert als farblose Nadeln und Prismen im orthorhombischen Kristallsystem. Es ist geruchlos und schmeckt bitter, wobei es in alkoholischer Lösung noch bitterer wird.[7] Bei der Destillation von Cinchonin mit Kaliumhydroxid wird Chinolin gebildet.[8]
(–)-Cinchonidin wird zur Spaltung von Racematen verwendet. Es bildet mit racemischen Säuren diastereomere Salze, die durch fraktionierte Kristallisation aufgetrennt werden können.[9] (–)-Cinchonidin gehört zu den Cinchona-Alkaloid-Katalysatoren, die als chirale Amine Lewis-Basen sind. Diese katalytischen Reaktionen sind in der org. Chemie vielfältig verwendbar. Ein Beispiel hierfür ist die 1,4-Additions-Reaktion nach Wynberg.[10]
Sicherheitshinweise[Bearbeiten | Quelltext bearbeiten]
Im Tierversuch mit Ratten wurde für (–)-Cinchonidin bei intraperitonealer Gabe ein LD50-Wert von 206 mg/kg ermittelt. Die Tiere waren auch bei subletalen Dosen vermindert aktiv bis schläfrig und zeigten Muskelzittern und Krämpfe.[3]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d Datenblatt Cinchonidin (PDF) bei Carl Roth, abgerufen am 9. Mai 2017.
- ↑ Datenblatt (–)-Cinchonidin bei Merck, abgerufen am 23. März 2011.
- ↑ a b Cecil C. Johnson, Charles F. Poe: Toxicity of Some Cinchona Alkaloids. In: Acta Pharmacologica et Toxicologica. Band 4, Nr. 3-4, 2009, S. 265–274, doi:10.1111/j.1600-0773.1948.tb03348.x.
- ↑ Daunderer: Klinische Toxikologie, Cinchonidin ffl-443; 69. Erg.-Lfg. 8.91.
- ↑ CINCHONIDINE (engl., PDF) In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 18. Juli 2021.
- ↑ a b Albert Gossauer: Struktur und Reaktivität der Biomoleküle, Verlag Helvetica Chimica Acta, Zürich, 2006, S. 495, ISBN 978-3-906390-29-1.
- ↑ Wittstein, M: On a New Cinchona Bark and Its Alkaloid, Cinchonidine. In: American Journal of Pharmacy. Nr. 115. Philadelphia März 1857 (proquest.com).
- ↑ Lueger, Otto; In: Lexikon der gesamten Technik, 1904, S. 142–146.
- ↑ L.F.Fieser, M.Fieser; In: Lehrbuch der organischen Chemie; 3. Auflage, Verlag Chemie, 1957, S. 300.
- ↑ H. J. Wynberg; In: J. Am. Chem. Soc., 1981, 103, S. 417–430.
