Cyclooctatetraen
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Cyclooctatetraen | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C8H8 | |||||||||||||||
| Kurzbeschreibung |
gelbe Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 104,15 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
0,93 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
142–143 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Brechungsindex |
1,5381 (20 °C)[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Cyclooctatetraen (COT) ist eine organisch-chemische Verbindung aus der Gruppe der cyclischen Kohlenwasserstoffe. Die Verbindung mit der Summenformel C8H8 besitzt vier konjugierte C=C-Doppelbindungen.
Im Gegensatz zu Benzol (C6H6) zählt COT nicht zu den aromatischen Kohlenwasserstoffen, da es aufgrund der Anzahl seiner π-Elektronen nicht der Hückel-Regel entspricht und auch nicht planar ist, sondern Wannenform aufweist.
Somit ist Cyclooctatetraen weder ein Aromat, noch ein Antiaromat.[4] Durch die fehlende aromatische Stabilisierung ist es eher den gewöhnlichen Polyenen vergleichbar, allerdings aufgrund der durch die Ringspannung verursachten Bindungswinkeldeformation von erhöhter Reaktivität.
Das wannenförmige COT-Molekül kann als Chelatligand – ähnlich wie 1,5-Cyclooctadien (COD) – Metallkomplexe bilden. Durch die Aufnahme von zwei Elektronen, z. B. durch Übertragung von einem Metall, wird aus dem COT das planare, aromatische Cyclooctatetraenyl-Anion C8H82− mit zehn π-Elektronen und erfüllt damit die Hückel-Regel. Ein bekanntes Beispiel für einen Komplex mit planaren Cyclooctatetraenyl-Liganden ist das Uranocen.
Vorkommen[Bearbeiten | Quelltext bearbeiten]
COT wurde in Tabakrauch nachgewiesen.[5]
Darstellung[Bearbeiten | Quelltext bearbeiten]
- COT wurde erstmals 1905 von Richard Willstätter aus Pseudopelletierin synthetisiert.[6]
- Die gängigste Synthese von COT erfolgt nach einem katalytischen Verfahren von Walter Reppe durch Cyclotetramerisierung von Ethin.[7]
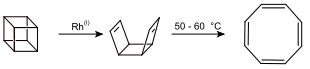
- Eine weitere Synthese geht vom Cuban aus. In Gegenwart von Rhodiumkatalysatoren wird zunächst das syn-Tricyclooctadien gebildet, welches anschließend thermisch bei 50–60 °C zum Cyclooctatetraen umgewandelt werden kann.[8]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Durch Erhitzen von Cyclooctatetraen 1 auf 100 °C erhält man ein Gemisch der beiden dimeren C16H16-Verbindungen 2 und 3. Das Dimer 2 (Schmelzpunkt 53 °C) entsteht durch eine Diels-Alder-Reaktion zweier Moleküle Cyclooctatetraen (1). Diese Reaktion ist bei hoher Temperatur teilweise reversibel. In einem zweiten Schritt lagert sich 2 in das Dimer 3 (Schmelzpunkt 76 °C) um.[9]
Aus der pentacyclischen Verbindung 3, die ein Homotropiliden-Strukturelement aufweist, erhält man durch UV-Bestrahlung unter Abspaltung von Benzol 5 den C10H10-Kohlenwasserstoff Bullvalen 4.[10]
Cyclooctatetraen findet Verwendung bei der Synthese von Korksäure und Cyclooctan.[11]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f Datenblatt Cyclooctatetraen bei Sigma-Aldrich, abgerufen am 12. Oktober 2023 (PDF).
- ↑ a b Datenblatt 1,3,5,7-Cyclooctatetraene, stabilized bei Fisher Scientific , abgerufen am 22. Dezember 2023 (PDF).
- ↑ a b David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-130.
- ↑ Frank-Gerrit Klärner: Wie antiaromatisch ist planares Cyclooctatetraen? In: Angewandte Chemie. Band 113, Nr. 21, 2001, S. 4099–4103, doi:10.1002/1521-3757(20011105)113:21<4099::AID-ANGE4099>3.0.CO;2-1.
- ↑ Alan Rodgman, Thomas A. Perfetti: The Chemical Components of Tobacco and Tobacco Smoke, Second Edition. Taylor & Francis, 2013, ISBN 978-1-4665-1548-2, S. 2107 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Richard Willstätter, Ernst Waser: Über Cyclo-octatetraen. In: Berichte der deutschen chemischen Gesellschaft. Band 44, Nr. 3, 1911, S. 3423–3445, doi:10.1002/cber.191104403216.
- ↑ Walter Reppe, Otto Schlichting, Karl Klager, Tim Toepel: Cyclisierende Polymerisation von Acetylen I. Über Cyclooctatetraen. In: Justus Liebigs Annalen der Chemie. Band 560, Nr. 1, 1948, S. 1–92, doi:10.1002/jlac.19485600102.
- ↑ L. Cessar, P.E. Eaton, J. Halpern: Catalysis of symmetry-restricted reactions by transition metal compounds. Valence isomerization of cubane, In J. Am. Chem. Soc. 92, 1972, S. 3515–3518. doi:10.1021/ja00714a075.
- ↑ Gerhard Schröder: Die Eigenschaften zweier dimerer Cyclooctatetraene vom Schmp. 53 und 76. In: Chemische Berichte. Band 97, Nr. 11, November 1964, S. 3131, doi:10.1002/cber.19640971124.
- ↑ Gerhard Schröder: Synthese und Eigenschaften von Tricyclo[ 3.3.2.04.6]decatrien-(2.7.9)2.3)(Bullvalen). In: Chemische Berichte. Band 97, Nr. 11, November 1964, S. 3140, doi:10.1002/cber.19640971125.
- ↑ Eintrag zu Cyclooctatetraen. In: Römpp Online. Georg Thieme Verlag, abgerufen am 27. September 2019.