Diethylacetamidomalonat
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Diethylacetamidomalonat | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C9H15NO5 | ||||||||||||||||||
| Kurzbeschreibung |
weißes Pulver[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 217,22 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
wenig löslich in Wasser und Diethylether, löslich in Trifluoressigsäure und Ethanol[3], sowie in Chloroform und Methanol[4] | ||||||||||||||||||
| Brechungsindex |
1,4640 (25 °C, 589 nm)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Diethylacetamidomalonat, DEAM ist ein Derivat des Malonsäurediethylesters und entsteht formal durch Acetylierung des Diethylesters der erstmals 1864 von Adolf Bayer beschriebenen instabilen Aminomalonsäure.[6][7] Diethylacetamidomalonat ist Ausgangsstoff für racemische natürliche und unnatürliche α-Aminosäuren oder α-Hydroxycarbonsäuren und Vorstufe für pharmazeutische Wirkstoffe, wie z. B. für das zur Therapie der Multiplen Sklerose eingesetzte Fingolimod.
Vorkommen und Darstellung[Bearbeiten | Quelltext bearbeiten]
Eine brauchbare Synthese für Acetamidomalonester ist in einem Patent[8] aus dem Jahr 1950 beschrieben, die eine Vorschrift aus Organic Syntheses[9] aufgreift. Danach wird Malonsäurediethylester in Eisessig mit Natriumnitrit (NaNO2) zum Diethylisonitrosomalonat (oder α-Oximinomalonsäurediethylester) umgesetzt.

Eine Lösung dieser Zwischenstufe in Eisessig/Acetanhydrid-Gemisch wird mit Zinkpulver zum Amin reduziert, das mit Acetanhydrid zum Endprodukt DEAM in einer Gesamtausbeute von 77 % acetyliert wird.
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Diethylacetamidomalonat ist ein weißes Pulver, das sich wenig in Wasser, aber gut in niederen Alkoholen und in Chloroform löst.
Anwendungen[Bearbeiten | Quelltext bearbeiten]
Synthese von α-Aminosäuren[Bearbeiten | Quelltext bearbeiten]
Diethylacetamidomalonat stellt eine geschützte Form der einfachsten achiralen α-Aminosäure Glycin dar. Das DEAM-Molekül weist ebenso eine Malonsäurediethylester-Struktur auf und eignet sich daher für Malonestersynthesen, die bei einfacher Alkylierung in einem dreistufigen Prozess – Deprotonierung, Alkylierung, Hydrolyse und gleichzeitige Decarboxylierung – racemische α-Aminosäuren liefern.
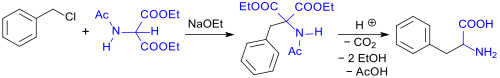
So entsteht Phenylalanin (rac-Phe) bei der Alkylierung von DEAM mit Benzylchlorid in Gegenwart der Base Natriumethoxid (NaOEt) und anschließender Hydrolyse der Carbonsäureester und -amidfunktionen und Decarboxylierung bei erhöhter Temperatur zur Monocarbonsäure in 65 %iger Ausbeute.[10][11]
Die oxidationsempfindliche Aminosäure rac-Tryptophan kann aus Diethylacetamidomalonat und Gramin (oder über dessen mit Methyliodid oder Dimethylsulfat erhältliches quartäres Ammoniumsalz) in Ausbeuten von > 90 % dargestellt werden.[12][13]

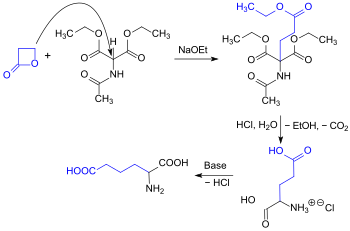
Die Alkylierung des Diethylacetamidomalonats kann auch mit dem gegenüber Nukleophilen sehr reaktiven Propiolacton erfolgen, wobei in einer Eintopfreaktion mit 87 % Ausbeute racemische Glutaminsäure gebildet wird.[14]
In ähnlicher Weise sind auch unnatürliche α-Aminosäuren, z. B. mit heterocyclischen Substituenten zugänglich.[15]
Die Reaktivität der Methylengruppe des Diethylacetamidomalonats kann umgekehrt werden (Umpolung), wenn man DEAM in die Dehydroform überführt, die nukleophil durch Lithiumalkyle, Grignard-Verbindungen oder Malonesteranionen angegriffen werden kann.[16]

Synthese von α-Hydroxycarbonsäuren[Bearbeiten | Quelltext bearbeiten]
Die Aminogruppe der synthetischen α-Aminosäuren kann durch Diazotierung und Verkochung gegen eine Hydroxygruppe ausgetauscht werden.

Die auf diesem Weg zugängliche Alkin-Carbonsäure 2-Hydroxy-4-pentinsäure kann mit Milchsäure copolymerisiert werden. An die Dreifachbindungen der an der Polymerkette hängenden Alkinreste im erhaltenen PLA-Copolymer können in einer schonenden und glatten Click-Reaktion funktionelle organische Azide zu 1,2,3-Triazolen cycloaddiert werden.[17]

Synthesen von Fingolimod[Bearbeiten | Quelltext bearbeiten]
Für das zur Behandlung der Multiplen Sklerose eingesetzte Immunsuppressivum Fingolimod wurden mehrere Syntheserouten mit dem Ausgangsstoff Diethylacetamidomalonat ausgearbeitet.[18] Schlüsselschritt in den mehrstufigen Synthesen ist meist die Alkylierung von DEAM mit z. B. 4‘-(2-Iodethyl)octanophenon.[19]

Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c Datenblatt Acetamidomalonsäurediethylester bei Sigma-Aldrich, abgerufen am 25. April 2022 (PDF).
- ↑ a b c Carl L. Yaws: Thermophysical Properties of Chemicals and Hydrocarbons, 2nd Edition. Elsevier Inc., Oxford, UK 2015, ISBN 978-0-323-28659-6, S. 250.
- ↑ William M. Haynes: CRC Handbook of Chemistry and Physics, 94th Edition. CRC Press, Boca Raton, FL, U.S.A. 2015, ISBN 978-1-4822-6097-7, S. 3–172.
- ↑ Datenblatt Diethyl acetamidomalonate, 98+% bei Alfa Aesar, abgerufen am 25. April 2022 (Seite nicht mehr abrufbar).
- ↑ a b Datenblatt Diethyl Acetamidomalonate, 99+% bei Fisher Scientific , abgerufen am 25. April 2022 (PDF).
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 2-Aminopropanedioic Acid: CAS-Nummer: 1068-84-4, PubChem: 100714, ChemSpider: 90998, DrugBank: DB02289, Wikidata: Q27093312.
- ↑ A. Baeyer: Untersuchungen über die Harnsäuregruppe. In: Liebigs Ann. Chem. Band 131, Nr. 3, 1864, S. 291–302, doi:10.1002/jlac.18641310306.
- ↑ Patent US2521809: Preparation of acetamidomalonates. Angemeldet am 9. Februar 1946, veröffentlicht am 12. September 1950, Anmelder: Merck & Co., Inc., Erfinder: M. Tishler, E.E. Howe.
- ↑ A.J. Zambino, E.E. Howe: Diethyl Acetamidomalonate In: Organic Syntheses. 40, 1960, S. 21, doi:10.15227/orgsyn.040.0021; Coll. Vol. 5, 1973, S. 373 (PDF).
- ↑ N.F. Albertson, S. Archer: The use of ethyl acetamidomalonate in the synthesis of amino acids. The preparation of dl-histidine, dl-phenylalanine and dl-leucine. In: J. Amer. Chem. Soc. Band 67, Nr. 2, 1945, S. 308–310, doi:10.1021/ja01218a046.
- ↑ H.R. Snyder, J.F. Shekleton, C.D. Lewis: Synthetic aminoacids. Syntheses from acetamidomalonic esters. In: J. Amer. Chem. Soc. Band 67, Nr. 2, 1945, S. 310–312, doi:10.1021/ja01218a047.
- ↑ N.F. Albertson, S. Archer, C.M. Suter: The synthesis of tryptophan from gramine. In: J. Amer. Chem. Soc. Band 67, Nr. 1, 1945, S. 36–37, doi:10.1021/ja01217a010.
- ↑ E.E. Howe, A.J. Zambito, H.R. Snyder, M. Tishler: The application of a new alkylation reaction to the synthesis of tryptophan. In: J. Amer. Chem. Soc. Band 67, Nr. 1, 1945, S. 38–39, doi:10.1021/ja01217a011.
- ↑ G. Talbot, R. Gaudry, L. Berlinguet: A convenient synthesis of DL-glutamic acid from β-propiolactone. In: Can. J. Chem. Band 34, Nr. 10, 1956, S. 1440–1443, doi:10.1139/v56-184.
- ↑ P.N. Rao, J.E. Burdett,Jr., J.W. Cessac, C.M. DiNunno, D.M. Peterson, H.K. Kim: Synthesis of 3-(3-pyridyl)- and 3-(3-benzo[b]thienyl)-D-alanine. In: Int. J. Pept. Protein Res. Band 29, Nr. 1, 1987, S. 118–125, doi:10.1111/j.1399-3011.1987.tb02237.x.
- ↑ F. Effenberger, T. Beißwenger: Eine einfache, allgemein anwendbare Synthese von N-Acetyl-dehydro-α-aminosäuren. In: Angew. Chem. Band 94, Nr. 3, 1982, S. 210, doi:10.1002/ange.19820940316.
- ↑ Q. Zhang, H. Ren, G.L. Baker: An economical and safe procedure to synthesize 2-hydroxy-4-pentynoic acid: A precursor towards ‚clickable‘ biodegradable polylactide. In: Beilstein J. Org. Chem. Band 10, 2014, S. 1365–1371, doi:10.3762/bjoc.10.139.
- ↑ N. Mulakayala: A comprehensive review on synthetic approach for Fingolimod. In: IJACS. Band 4, Nr. 4, 2016, S. 362–366 (ijacskros.com [PDF]).
- ↑ Patent EP0989113A1: Processes for producing 2-aminomalonic acid derivatives and 2-amino-1,3-propanediol derivatives, and intermediates for producing the derivatives. Angemeldet am 3. Juli 1998, veröffentlicht am 29. März 2000, Anmelder: Taito Co., Ltd., Erfinder: S. Hirase, S. Sasaki, M. Yoneta, R. Hirose, T. Fujita.
