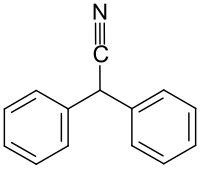
Diphenylacetonitril
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Diphenylacetonitril | ||||||||||||||||||
| Summenformel | C14H11N | ||||||||||||||||||
| Kurzbeschreibung |
beiger Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 193,24 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Schmelzpunkt |
71–73 °C[1] | ||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser[2] | ||||||||||||||||||
| Brechungsindex |
1,67[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Diphenylacetonitril ist eine chemische Verbindung aus der Stoffgruppe der Nitrile.
Synthese[Bearbeiten | Quelltext bearbeiten]
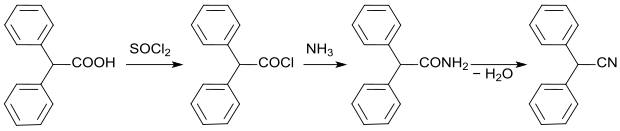
Eine Synthese des Diphenylacetonitrils geht von der Diphenylessigsäure aus, die mit Thionylchlorid zum Säurechlorid umgesetzt wird. Anschließend erfolgt mit Ammoniak die Reaktion zum Amid, das durch Wasserabspaltung zum Diphenylacetonitril reagiert.
Die erste Synthese durch Anschütz (1888) galt als unpraktikabel; spätere Arbeiten bezogen sich daher auf eine Synthesevorschrift auf Grundlage von Diphenylessigsäure.[4] Der französische Chemiker Joseph Hoch ging von Phenylacetonitril aus, das zu Brombenzylcyanid bromiert und mit Benzol und wasserfreiem AlCl3 zum Endprodukt reagiert.[5][6][7]
Verwendung[Bearbeiten | Quelltext bearbeiten]
Diphenylacetonitril wird in verschiedenen Wirkstoff-Synthesen verwendet, die bedeutendsten ist die von racemischem Methadon.[8]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f g Datenblatt Diphenylacetonitril bei Sigma-Aldrich, abgerufen am 5. Februar 2022 (PDF).
- ↑ Datenblatt Diphenylacetonitril bei Alfa Aesar, abgerufen am 15. Februar 2022 (Seite nicht mehr abrufbar).
- ↑ Harry A. Rose (Eli Lilly): Crystallographic Data: 172. Diphenylacetonitrile. In: Analytical Chemistry. Band 30, Nr. 8, August 1958, S. 1441, doi:10.1021/ac60140a600.
- ↑ K. Neure: Ueber substituirte Benzylcyanide. In: Justus Liebig’s Annalen der Chemie. Band 250, Nr. 1-2, 1889, S. 140–156, doi:10.1002/jlac.18892500105 (gemeinfrei: Die Gewinnung des schon früher auf anderem Wege von Anschütz erhaltenen Diphenylacetonitrils aus Diphenylbrommethan und Cyanquecksilber bietet Schwierigkeiten. Die zähe, braune Schmelze, welche durch Erhitzen jener beiden Verbindungen erhalten wird, ist schwer zu verarbeiten und die Ausbeute an Nitril nur gering. Es wurde daher folgender, allerdings umständliche, aber lohnende Weg zur Darstellung benutzt. Die nach dem von Klinger angegebenem Verfahren dargestellte Benzilsäure wurde mittelst Jodwasserstoffsäure vom Siedepunkt 127° zu Diphenylessigsaure reducirt. Letztere wurde auf dem Wasserbade getrocknet, durch Auflösen in Aether und Einleiten gut getrockneten Ammoniaks in ihr Ammoniumsalz übergeführt und dieses nach dem Hofmannschen Verfahren durch 6 stündiges Erhitzen auf 230° im geschlossenen Rohre in das Amid übergeführt.).
- ↑ Joseph Hoch: Méthode générale de préparation des di et triarylacétonitriles. In: Comptes Rendu. Band 197, 1933, S. 770–772 (Digitalisat auf Gallica).
- ↑ Gunther Lock, Vinzenz Rieger (EBEWE): Notiz über eine einfache Herstellungsweise von Diphenylacetonitril. In: Chemische Berichte. Band 86, Nr. 1, Januar 1953, S. 74–76, doi:10.1002/cber.19530860114.
- ↑ David Ginsburg, Manuel M. Baizer: Diphenylacetonitrile. In: Journal of the American Chemical Society. Band 71, Nr. 6, Juni 1949, S. 2254, doi:10.1021/ja01174a512.
- ↑ Everett M. Schultz, Charles M. Robb, James M. Sprague: The Reaction of 1-Dimethylamino-2-chloropropane with Diphenylacetonitrile. The Structure of Amidone. In: Journal of the American Chemical Society. Band 69, Nr. 10, Oktober 1947, S. 2454–2459, doi:10.1021/ja01202a061.