Diphenylessigsäure
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Diphenylessigsäure | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C14H12O2 | |||||||||||||||||||||
| Kurzbeschreibung |
weißes Pulver[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 212,24 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte | ||||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt | ||||||||||||||||||||||
| Löslichkeit |
| |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Diphenylessigsäure (DPAA) ist ein Diphenylmethan, bei dem ein Wasserstoffatom der Methylengruppe durch eine Carboxylgruppe ersetzt ist. Die Verbindung kann auch als Essigsäure aufgefasst werden, an deren Methylgruppe zwei Wasserstoffatome durch zwei Phenylgruppen substituiert sind. Die Verbindung wird zur Bestimmung des Aktivgehalts von lithiumorganischen Verbindungen, z. B. Butyllithium (BuLi), verwendet und ist Ausgangsstoff für Pflanzenschutzmittel und Pharmaka.
Vorkommen und Darstellung[Bearbeiten | Quelltext bearbeiten]
Die erste Darstellung von Diphenylessigsäure wurde 1870 berichtet, wobei Benzilsäure mehrere Stunden mit Iodwasserstoffsäure (HI) erhitzt wurde.[3]
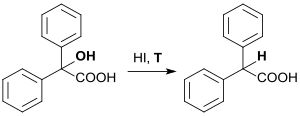
Theodor Zincke verifizierte 1873[4] bzw. 1874[5] die Befunde des Erstautors und beschrieb die Synthese aus α-Bromphenylessigsäure[6], die mit Benzol und Zinkstaub (Zn) zu Diphenylessigsäure umgesetzt wurde.
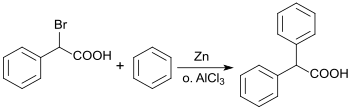
Die Reaktion kann auch mit Aluminiumtrichlorid (AlCl3) katalysiert werden.[7]
In Laborsynthesen, die auf diese älteren Arbeiten basieren, wird Benzilsäure mit rotem Phosphor und Iod (I2) in Wasser oder mit Phosphor und Iodwasserstoffsäure HI in Essigsäure[8] zu Diphenylessigsäure reduziert.[9]

Die Reduktion der Benzilsäure verläuft mit hohen Ausbeuten (94 – 97 %).
Alternativ kann Benzol mit Chloral zu Diphenyltrichlorethan (I) kondensiert werden, das im Alkalischen unter Abspaltung von Chlorwasserstoff (HCl) zu Diphenyldichlorethen (II) reagiert. Im letzten Schritt wird die Dichlorethenfunktion mit Natriumethanolat zu Diphenylessigsäure hydrolysiert.[10]

In jüngerer Zeit wurde eine Synthese von DPAA berichtet, die wiederum von Benzilsäure ausgeht und teure Reaktanden und problematische Nebenprodukte vermeidet.[11] Dabei wird unter Katalyse mit p-Toluolsulfonsäure Benzilsäure zum cyclischen Diester umgesetzt, der an einem Palladium-Kontakt mit Wasserstoff zu Diphenylessigsäure gespalten wird.

Mit einer Reinproduktausbeute von 91 % (in ca. 100-g-Ansätzen) scheint diese Variante ökonomische und ökologische Vorteile gegenüber den historischen Synthesewegen zu bieten.
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Diphenylessigsäure ist ein weißer, geruchloser, kristalliner Feststoff, der in kaltem Wasser sehr wenig, in heißem Wasser, Ethanol und Ether dagegen gut löslich ist. Beim Umkristallisieren aus heißem Wasser fällt die Substanz als Nadeln aus.[7]
Anwendungen[Bearbeiten | Quelltext bearbeiten]
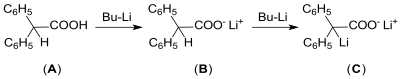
Wegen der Empfindlichkeit lithiumorganischer Verbindungen in organischen Lösungsmitteln, wie z. B. BuLi, gegenüber Feuchtigkeit und Sauerstoff sollte der Aktivgehalt durch Titration mit Diphenylessigsäure in trockenem Tetrahydrofuran (THF) bestimmt werden. Der Umschlag der Farbe von farblos – (A) und (B) – auf gelb (C) gibt dabei den Endpunkt an.[12]
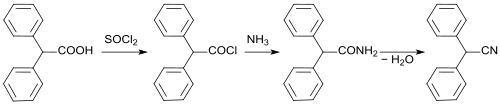
Das als Synthesebaustein interessante Diphenylketen ist aus Diphenylessigsäure über das Säurechlorid einfach zugänglich.[13]
Über das Säureamid kann Diphenylacetonitril in guter Ausbeute erhalten werden.
Ausgehend von Diphenylacetonitril kann das Analeptikum Doxapram in einer mehrstufigen Reaktionsfolge synthetisiert werden.[14]
Das Herbizid Diphenamid entsteht in hoher Ausbeute (95,3 %) und Reinheit (99,9 %) bei der Umsetzung des Diphenylessigsäuremethylesters mit Dimethylamin.[15]

Dextromoramid, ein starkes Opioid-Analgetikum, kann in einem mehrstufigen Prozess aus Diphenylessigsäure über das entsprechende Säurechlorid (Diphenylacetylchlorid[16]) bzw. über Diphenylacetonitril ebenso wie Methadon oder das Antidiarrhoikum Diphenoxylat[17] hergestellt werden.

Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f g h Datenblatt Diphenylessigsäure bei Sigma-Aldrich, abgerufen am 5. Februar 2022 (PDF).
- ↑ Michael D. Larrañaga, Richard J. Lewis, Sr., Robert A. Lewis: Hawley’s Condensed Chemical Dictionary, 16th Edition. John Wiley & Sons, Inc., Hoboken, NJ, U.S.A. 2016, ISBN 978-1-118-13515-0, S. 514.
- ↑ A. Jena: Ueber die Benzilsäure oder Diphenylglycolsäure. In: Justus Liebigs Ann. Chem. Band 155, Nr. 1, 1870, S. 77–89, doi:10.1002/jlac.18701550107.
- ↑ R. Symons, T. Zincke: Ueber Diphenylessigsäure und Benzilsäure. In: Chem. Ber. Band 6, Nr. 2, 1873, S. 1188–1191, doi:10.1002/cber.187300602102.
- ↑ R. Symons, T. Zincke: Ueber Benzilsäure und Diphenylessigsäure. In: Justus Liebigs Ann. Chem. Band 171, Nr. 1, 1874, S. 117–134, doi:10.1002/jlac.18741710110.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 2-Bromo-2-phenylacetic acid: CAS-Nummer: 4870-65-9, EG-Nummer: 225-477-4, ECHA-InfoCard: 100.023.161, PubChem: 97919, ChemSpider: 88392, Wikidata: Q72449129.
- ↑ a b I.F. Eykman: Over synthese van eenige aromatische zuren. In: Chem. Weekblad. Band 5, Nr. 35, 1908, S. 655–672 (rug.nl).
- ↑ F. Klingemann: Beiträge zur Kenntnis der Diphenylessigsäure. In: Justus Liebigs Ann. Chem. Band 275, Nr. 1, 1893, S. 83–89, doi:10.1002/jlac.18932750107.
- ↑ C.S. Marvel, F.D. Hager, E.C. Caudle: Diphenylacetic Acid In: Organic Syntheses. 3, 1923, S. 45, doi:10.15227/orgsyn.003.0045; Coll. Vol. 1, 1941, S. 224 (PDF).
- ↑ P. Fritsch, F. Feldmann: Synthese aromatisch disubstituirter Essigsäuren mittelst Chloral. In: Justus Liebigs Ann. Chem. Band 306, Nr. 1–2), 1899, S. 72–86, doi:10.1002/jlac.18993060106.
- ↑ P. Strazzolini, A.G. Guimanini, G. Verardo: Diphenylacetic acid from benzilic acid: An ecologically and economically improved procedure. In: Synth. Commun. Band 17, Nr. 16, 1987, S. 1919–1928, doi:10.1080/00397918708057804.
- ↑ W.G. Kofron, L.M. Baclawski: A convenient method for estimation of alkyllithium concentrations. In: J. Org. Chem. Band 41, Nr. 10, 1976, S. 1879–1880, doi:10.1021/jo00872a047.
- ↑ E.C. Taylor, A. McKillop, G.H. Hawks: Diphenylketene In: Organic Syntheses. 52, 1972, S. 36, doi:10.15227/orgsyn.052.0036; Coll. Vol. 6, 1988, S. 549 (PDF).
- ↑ Ruben Vardanyan, Victor Hruby: Synthesis of Essential Drugs. Elsevier B.V., Amsterdam, NL 2006, ISBN 978-0-444-52166-8, S. 122.
- ↑ Patent DE3835741A1: Verfahren zur Herstellung von Diphenylessigsäuredimethylamid. Angemeldet am 20. Oktober 1988, veröffentlicht am 10. Mai 1990, Anmelder: Lentia GmbH, Erfinder: J. Schweighofer, M. Wechsberg, R. Hermanseder.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 2,2-diphenylacetyl chloride: CAS-Nummer: 1871-76-7, EG-Nummer: 217-493-5, ECHA-InfoCard: 100.015.903, PubChem: 74637, ChemSpider: 67212, Wikidata: Q27263827.
- ↑ Ruben Vardanyan, Victor Hruby: Synthesis of Essential Drugs. Elsevier B.V., Amsterdam, NL 2006, ISBN 978-0-444-52166-8, S. 31.
