Diskussion:Oxidationszahl
Füge neue Diskussionsthemen unten an:
Klicke auf , um ein neues Diskussionsthema zu beginnen.Wertigkeit[Quelltext bearbeiten]
"Die Oxidationszahl gibt an, wieviele Elektronen ein neutrales Atom innerhalb einer Verbindung formal aufgenommen (positive Werte) beziehungsweise abgegeben (negative Werte) hat."
Ist es nicht genau umgekehrt: wenn ein neutrales Atom ein Elektron aufnimmt, wird es negativ (Ion) und bekommt damit eine negative Oxidationszahl, z.B. Fluor -1.
Timm22 16:08, 30. Jun 2004 (CEST)
Du hast natürlich recht. --Grien 16:12, 30. Jun 2004 (CEST)
Oxidationszahl über Atomsymbol[Quelltext bearbeiten]
Die Oxidationszahl wird direkt über das Atomsymbol geschrieben:
und nicht
Anscheinend gibt es dazu jedoch noch keine Möglichkeit, das sauber in TeX darzustellen. --Wollschaf 20:15, 14. Jul 2004 (CEST)
Mit der Vorlage:oxz würde es gehen:
Allerdings geht diese Schreibweise mit einem Zeilenumbruch einher. --Dg.de 18:43, 20. Jan. 2008 (CET)
- Ausdiesem Grund ist die derzeitige Umsetzung in Vorlage:oxz mangelhaft. Die oben von Wollschaf beschriebene Form in LaTeX ist wahrscheinlich die einzigmögliche in der Wikipedia. Im Fliestext zerstört sie aber das Layout. Ich denke hier muss man ähnlich wie bei verkürzten Leerzeichen usw. einfach einen Kompromiss zwischen Machbarkeit und Korrektheit finden. --Cepheiden 19:45, 20. Jan. 2008 (CET)
Frage zu folgendem Abschnitt[Quelltext bearbeiten]
Mal ne frage zu folgendem Abschnitt ==>Regeln 1,6,7 gelten immer, ==>Regel 2 gilt nicht, wenn Wasserstoff mit „elektropositiveren“ Atomen wie Metallen (Hydride) oder sich selbst direkt verbunden ist. ==>Regel 3 gilt nicht in Verbindungen, in denen Sauerstoff direkt mit sich selbst oder mit Fluor verbunden ist.
Regel 5 gilt doch auch immer??
hilfsregeln[Quelltext bearbeiten]
bei punkt 5 (sauerstoff) könnte als ausnahme auch noch wasserstoffperoxid rein, oder?
- Nein, für bei Oxidationszahl muss jede einzelne Bindung betrachten werden. Bei Wasserstoffperoxid hat jedes Sauerstofatom eine bindung zu einem Wasserstofatom und eine bindung zum anderen Sauerstoffatom. Bindungen zwischen gleichen Elementen zählen immer als 0 (gilt für die Sauerstoffbindung). Für die Verbindung zum Wasserstoff bleibt also nur noch -1 übrig und Wasserstoff hat dann logischeweise die OZ +1. --Cepheiden 13:15, 25. Jan 2006 (CET)
- Evtl, sollten die Hilfregeln etwas überarbeitet und klarer formuliert werden. z. B. widersprechen sich Hilfregel 5 und 6 teilweise. --Cepheiden 13:32, 25. Jan 2006 (CET)
- Sauerstoffverbindungen mit Sauerstoff in anderen Oxidationsstufen sind Peroxide (-1), Hyperoxide (-½), Ozonide (-1/3) und Salze mit dem Dioxygenyl-Kation O2+ (+½). Oxide
- Das stimmt zwar alles, doch ist es schon sehr speziell für Hilfsregeln. Zumal es alles über andere Hilfsregeln herleitbar ist. --Cepheiden 18:05, 24. Jul 2006 (CEST)
Bild als Beispiel?[Quelltext bearbeiten]
Ich habe zwei Bilder erstellt, die man als Hilfestellung für die zeichnerische Bestimmung der Oxidatioszahlen verwenden könnte. Verbesserungswürdig sind sie allemal, dann können sie auch in den Artikel eingearbeitet werden.
Oxidationszahlenbeispiel Methan: Datei:Oxidationszahlen methan.png
und
Oxidationszahlenbeispiel Ethan: Datei:Oxidationszahlen ethan.png
mfg
Karbrüggen 23:18, 4. Apr 2006 (CEST)
Weiß nicht so recht ob solche Bilder für das Verständnis viel bringen, schaden tun sie aber sicherlich nciht. Allerdings hast du einen Fehler im Bild für Methan. Die Oxidationszahl des Kohlenstoffatoms ist dort -IV mfg --Cepheiden10:24, 5. Apr 2006 (CEST)
- Hoppala... War ja eh nur als Beispiel gedacht ;-) Werde dann mal ein paar Beispiele aufzeichnen. Generelle Wünsche nach besonderen Formeln dürfen gestellt werden.
- mfg
Karbrüggen 13:28, 10. Apr 2006 (CEST)- So, als (erweitertes) Beispiel die Phosphorsäure:
- Datei:Oxidationszahlen phosphorsäure.png
- mfg
Karbrüggen 15:46, 10. Apr 2006 (CEST)
- mfg
- Ich würde es auch gut finden, wenn ein einfaches und ein etwas kompexeres Beispiel behandelt wird. Ich denk da vorallem auch an ein organisches Material bei dem Kohlenstoff unterschiedliche Oxidationszahlen hat. --Cepheiden 08:40, 20. Apr 2006 (CEST)
- Hm, wie wäre es gleich mit der Oxidation von einem Alkanal zu einer Carbonsäure, bspw. bei der Tollensprobe? Dort können einerseits gezeigt werden, dass verschiedene C-Atome unterschiedliche Oxidationszahlen haben können, und andererseits, dass das selbe C-Atom (einmal in Alkanal, und einmal in der Säure) durch die Reaktion andere Oxidationszahlen annehmen kann.
- Ich würde mich da gern ran machen, vor allem würde ich es gerne als SVG anbieten (und ebanfalls obiges Bild ersetzen). Aber ich muss mich damit erst mal vertraut machen...
- mfg Karbrüggen 15:25, 23. Jul 2006 (CEST)
- So, mein zweiter Versuch (Versuch 1 ist bereits im Artikel selbst zu erkennen):
- So, mein zweiter Versuch (Versuch 1 ist bereits im Artikel selbst zu erkennen):
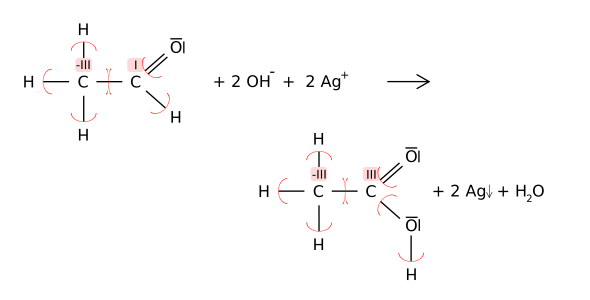
- Leider scheine ich noch nicht so ganz mit dem Programm zurechtzukommen, denn sowohl in Inkscape, als auch beim direkten Betrachten der SVG-Datei in Firefox 1.5 wird das XML richtig interpretiert, der Wikipedia-Parser aber versetzt die Ladungen sowie den "fällt aus"-Pfeil... Vielleicht kann da jemand besser mit um als ich.
- mfg Karbrüggen 19:03, 23. Jul 2006 (CEST)
- Leider scheine ich noch nicht so ganz mit dem Programm zurechtzukommen, denn sowohl in Inkscape, als auch beim direkten Betrachten der SVG-Datei in Firefox 1.5 wird das XML richtig interpretiert, der Wikipedia-Parser aber versetzt die Ladungen sowie den "fällt aus"-Pfeil... Vielleicht kann da jemand besser mit um als ich.
- Das Problem kenn ich, aber wie man dem Wiki-Parser das abgewohnt weiß ich auch nicht --Cepheiden 18:07, 24. Jul 2006 (CEST)
- Habs mit Hilfe gelöst bekommen, eine neue Version liegt jetzt in den Commons: commons:Image:Redox_Tollens_Oxidationszahlen_C.svg. Wie binde ich das hier ein?
- MfG Karbrüggen 10:54, 2. Aug 2006 (CEST)
Die Bilder sind sehr gut, für meinen Geschmack jedoch zu anleitungs- und lehrbuchhaft. Ich habe sie daher bei Commons hochgeladen und ins Wikilehrbuch eingebaut. Matthias M. 16:52, 11. Apr. 2009 (CEST)
Also ich finde die Vorgehensweise, wie sie in diesen Bilder dargestellt ist (Elektronegativität der Bindungspartner einer Bindung bestimmen, ist die des einen grösser, bekommt er beide Elektroenen usw. (das kann man ja so machen, oder???)), viel einfacher, als die nach den Regeln. Sieht man sich die Hilfsregeln an, muss man auf so viele Beispiele achten, und ausserdem muss man die Regeln z.B. für eine Klausur auch auswendig lernen. Bei der Methode der Elektronegativität muss man gar nichts lernen und nicht auf Sonderregeln und Ausnahmen achten, dennoch ist davon in dem Artikel z.B. unter "Bestimmung der Oxidationszahlen" nicht die Rede. Insofern kann ich mich nur für ein Einbringen der Bilder in den Artikel einsetzten. 21:04, 18. März 2011 (CEST) (ohne Benutzername signierter Beitrag von Römert (Diskussion | Beiträge) )
- ein Bild ist drin Dieser Abschnitt kann archiviert werden. 92.192.90.96 11:09, 11. Mär. 2014 (CET)
Danke[Quelltext bearbeiten]
Vielen Dank an alle die hier mitwirken. Die Seite hat mir fürs lernen sehr viel weitergeholfen.
- Noch jemand, der sein Abi in Chemie vor sich hat? ;-) --Karbrüggen 23:16, 19. Apr 2006 (CEST)
- Ich danke ebenfalls - Ebenfalls auch Abiprüfung in Chemie.. aber erst in 2 Jahren - Micha
Kommentar zur grafischen Interpretation[Quelltext bearbeiten]
Nach meinem letzten Rev. darf ich nochmal kurz erklären warum das so ist, und erstmal nichts mit der Oktettregel zu tun hat. Diese dient im Prinzip dazu, die Lewis-Schreibweise formulieren zu können. Die Erklärung Beispiel: Sauerstoff besitzt eigentlich 6 Valenzelektronen. Um eine stabile vollbesetzte Valenzschale zu erhalten ist es am energetisch günstigsten zwei Elektronen aufzunehmen, z. B. bei den gemeinsamgenutzten Bindungselektronen im O2-Molekül. Da wird richtiges mit falschen zusammengeworfen. Klar ist die Oktettregel im O2-Molekül erfüllt, hat aber mit der Oxidationszahl des Sauerstoffs nichts zu tun, diese beträgt dort trotzdem 0 (siehe Regel 1 bei 'Bestimmung der Oxidationszahl)! Wenn das richtig wäre, dann hätte der Phosphor die Oxidationszahl -III (braucht neben seinen fünf Valenzelektronen noch drei weitere zur Erfüllung der Okettregel). Also sollte man lieber bei der Elektronegativität bleiben... --Lode (bla) 16:20, 30. Mai 2006 (CEST)
Englische Wikipedia[Quelltext bearbeiten]
Wer gut Englisch (verstehen) kann, findet mehr als genügend Informationen.
Siehe auch:
- Diskussion der Liste der Oxidationsstufen der chemischen Elemente und
- Diskussion der Liste der Wertigkeiten der chemischen Elemente.
Jens Liebenau 12:26, 28. Sep. 2008 (CEST)
- Ich denke, dass jeder, der Englisch kann, auch über die Verküpfungen dort sucht. Ziel sollte es aber eher sein, die deutsche Version so zu verbessern, dass dies gar nicht erst notwenig wäre. --Cepheiden 12:29, 28. Sep. 2008 (CEST)
- Die meisten Informationen sind im Internet selbstverständlich in englischer Sprache verfasst. In der Englischen Wikipedia sind bereits zuverlässige Quellen und Texte vorhanden. Leider ist es nun einmal so und auf diesem Weg müsste der Artikel eigentlich am schnellsten verbessert werden. Liebe Grüße Jens Liebenau 12:36, 28. Sep. 2008 (CEST)
- Na dann los, Sei mutig! :-) P.S. bitte ändere nie Diskussionsbeiträge von anderen Nutzern (auch nicht Rechtschreibung, Zeilenumbrüche o.ä.). Das gilt als unhöflich (sieh auch Wikipedia:Diskussionsseiten oder Wikipedia:Wikiquette --Cepheiden 12:48, 28. Sep. 2008 (CEST)
- Die meisten Informationen sind im Internet selbstverständlich in englischer Sprache verfasst. In der Englischen Wikipedia sind bereits zuverlässige Quellen und Texte vorhanden. Leider ist es nun einmal so und auf diesem Weg müsste der Artikel eigentlich am schnellsten verbessert werden. Liebe Grüße Jens Liebenau 12:36, 28. Sep. 2008 (CEST)
Unterschied zwischen en:oxidation state und en:oxidation number[Quelltext bearbeiten]
Beide verweisen auf den gleichen dt. Wikipedia-Artikel, aber sie behaupten: "The oxidation state can differ from the oxidation number in a few cases [...]" :-| --RokerHRO 23:08, 27. Feb. 2010 (CET)
- In der deutschen Wiki wird Oxidationszahl und Oxidationsstatus synonym dargestellt, was jedoch falsch ist, da in der IUPAC-Norm zwischen -state und -number inhaltlich wie in der formellen Darstellung unterschieden wird. Daraus resultiert der weitere Fehler, die Oxidationszahl sei sowohl in arabischen wie in römischen Ziffern zulässig. Tatsächlich wird -numer in römischen, der -state mit arabischen Ziffern gekennzeichnet. In Universitäten wird dies nach wie vor korrekt verwendet, da wiki-Autoren aber eher nicht die jeweiligen Fachbereiche studiert haben, ist das dann auch eher unbekannt. (nicht signierter Beitrag von 217.224.223.39 (Diskussion) 01:11, 16. Mai 2012 (CEST))
- Das hat nichts mit Laienautoren oder "Wiki-Bullshit" (bitte Wikipedia:Wikiquette beachten!) zu tun, sondern damit, dass sich nur wenige Menschen um die formale Korrektheit bei Chemiegrundlagen interessieren. Außerdem schreibt die IUPAC-Regel zu oxidation state nicht explizit vor, dass man arabische Ziffern verwenden soll. Die Oxidationszahl römisch zu schreiben ist einfach nur die klassische Variante [1]. Gruß Matthias (Diskussion) 18:58, 5. Aug. 2012 (CEST)
- In der deutschen Wiki wird Oxidationszahl und Oxidationsstatus synonym dargestellt, was jedoch falsch ist, da in der IUPAC-Norm zwischen -state und -number inhaltlich wie in der formellen Darstellung unterschieden wird. Daraus resultiert der weitere Fehler, die Oxidationszahl sei sowohl in arabischen wie in römischen Ziffern zulässig. Tatsächlich wird -numer in römischen, der -state mit arabischen Ziffern gekennzeichnet. In Universitäten wird dies nach wie vor korrekt verwendet, da wiki-Autoren aber eher nicht die jeweiligen Fachbereiche studiert haben, ist das dann auch eher unbekannt. (nicht signierter Beitrag von 217.224.223.39 (Diskussion) 01:11, 16. Mai 2012 (CEST))
- en:wiki ist geändert worden
- Ich weiss ist jetzt etwas alte Fasnacht, doch widerspreche ich gemäss IUPAC: «oxidation number: In English is largely synonymous with oxidation state» https://doi.org/10.1351/goldbook.O0436--MichelleLily14 (Diskussion) 14:25, 1. Apr. 2020 (CEST)
"Nicht-ganzzahlige Oxidationszahlen werden nicht verwendet."[Quelltext bearbeiten]
Unter Hilfsregeln Sauerstoff: "[...] und in Hyperoxiden (dann −0,5) [...]"
mfg--80.212.73.51 05:17, 1. Feb. 2012 (CET)
- doch doch, schon möglich. Darauf sollte der Artikel vll. explizit eingehen--92.203.12.27 20:22, 30. Jul. 2012 (CEST)
Link zur englischen Seite ist falsch[Quelltext bearbeiten]
Der Link zur englischsprachigen Seite leitet zu "Oxidation state" weiter. Es sollte aber "Oxidation number" sein. Darauf wird sogar am Anfang beider Seiten hingewiesen, dass diese leicht zu verwechseln sind. Ich weiss aber nicht, wie man das bearbeiten kann. Koennte dass also bitte irgendjemand aendern? Schoene Gruesse :) Homer (nicht signierter Beitrag von HomerJSimpson96 (Diskussion | Beiträge) 14:36, 13. Sep. 2012 (CEST))
- en:wiki ist geändert worden Dieser Abschnitt kann archiviert werden. 92.192.90.96 11:08, 11. Mär. 2014 (CET)
Strukturierung[Quelltext bearbeiten]
Meiner Meinung nach ist die Strukturierung des Artikels verbesserungsfähig. Insbesondere die Einleitung halte ich mit vier Abschnitten für zu lang. Kann man Teile davon in einen Abschnitt verschieben? --Leyo 14:33, 20. Feb. 2015 (CET)
Angabe der Oxidationszahl[Quelltext bearbeiten]
Nach dem guten Satz: "Grundsätzlich ist die Summe der Oxidationszahlen der Atome einer molekularen Verbindung gleich Null." ist ein Satz wie dieser: "Bei stöchiometrisch richtig aufgestellten Redoxreaktionen ist die Summe der Oxidationszahlen der Edukte gleich der Summe der Oxidationszahlen der Produkte." nicht angemessen, er sollte so nicht formuliert werden. Entweder dient die Aussage der Definition, dann müsste sie lauten: "Bei jeder chemischen Reaktion bleibt neben der Anzahl der Atome auch die Oxidationszahl erhalten; d.h. die Oxidationszahl der Edukte ist gleich der der Produkte." oder diese Aussage ist wegen des Adjektivs "richtig" so schwach, dass sie entfallen sollte. Anmerkung: wir haben es in der Chemie nicht nur mit Stoffumwandlungen zu tun, sondern diese unterliegen sehr genau formulierbaren Erhaltungsgesetzen; ein Stoff verschwindet zwar, ein neuer wird gebildet, die Stöchiometrie macht die quantitativen Aussagen über solche Umwandlungen. mfG --TumtraH-PumA (Diskussion) 10:30, 24. Sep. 2015 (CEST)
- @ Das riecht nach ziemlich hochgestochener Verwirrung. --RuessRGB (Diskussion) 12:03, 21. Jun. 2019 (CEST)
Tollens Probe[Quelltext bearbeiten]
Die ersten beiden einleitenden Sätze zur Tollensprobe halte ich für merkwürdig bis falsch. Die logische Folgerung mit "Daher" am Anfang erschließt sich mir nicht. Im dritten Satz steht eine Selbstverständlichkeit und nichts über die Bilanz der Oxidationszahlen. Liege ich richtig? Wenn ja muss das weg bzw. geändert werden.--RuessRGB (Diskussion) 16:16, 19. Jun. 2019 (CEST) Als ich mit der Änderung beginnen wollte, habe ich vorher den Artikel gelesen und dabei ein ziemliches Durcheinander entdeckt. Die Beseitigung mit einer besseren Strukturierung hat viel Zeit gekostet und war mühsam. Jetzt bin ich beim letzten und sehr wichtigen Kapitel angekommen. --RuessRGB (Diskussion) 18:49, 22. Jun. 2019 (CEST) Ich habe die Renovierung des Artikels mit wenigen Streichungen aber mit vielen Verschiebungen und mit einer teilweise neuen Gliederung abgeschlossen. Sicher sind Fehler zu beseitigen und besonders die Verlinkungen müssen wohl noch eingeschränkt werden. Aber jetzt brauche ich zunächst eine Pause.--RuessRGB (Diskussion) 17:54, 23. Jun. 2019 (CEST)
In der deutschen Version steht, dass die Oxidationszahl 0 mit ±0 angegeben wird. Im englischen Artikel, sowie bei den Angaben von Golden Book habe ich diesbezüglich nichts gefunden. Sonst aus der Literatur kenne ich das auch nicht. Woher kommt das?--MichelleLily14 (Diskussion) 14:29, 1. Apr. 2020 (CEST)
hätte hätte hätte[Quelltext bearbeiten]
Einleitung 6. Satz:
- Die höchst mögliche bzw. die niedrigst mögliche Oxidationszahl hätte ein Atom in einer Verbindung oder in einem Ion dann erreicht, wenn es so viele Elektronen abgegeben bzw. aufgenommen hätte, dass es die nächste Edelgaskonfiguration erreicht hätte.
geht das nicht ohne dreimal hätte ? --Präziser (Diskussion) 06:17, 28. Jun. 2021 (CEST)
- @ Wird erledigt! --RuessRGB (Diskussion) 12:13, 28. Jun. 2021 (CEST)
Kritik an wertender Formulierung[Quelltext bearbeiten]
Die Qualität des Artikels ist problematisch.
U.a. folgende Formulierungen sind wertend und unwissenschaftlich:
- "Die einfach zu ermittelnden Oxidationszahlen sind in der anorganischen und organischen Chemie zum Verständnis von Redoxreaktionen wichtig und bei der Formulierung von Redoxgleichungen sehr hilfreich."
- "Oxidationszahlen haben eine große Bedeutung bei der sachgerechten Formulierung und Bestimmung der Stöchiometrie von Redoxreaktionen."
- "Die Angabe der oxidation number ist wichtig bei der Nomenklatur [...]"
Des weiteren wirft der Artikel fachliche Fragen auf, z.B.:
- Die folgende Aussage verkennt die Tatsache, dass vor der Verbreitung des Begriffs "Oxidationszahl" die "Wertigkeit" geläufig war, und es wird nicht beschrieben, warum er dies nicht mehr ist: "Die Angabe der oxidation number ist wichtig bei der Nomenklatur von anorganischen Salzen, z. B. im Falle von Eisen(III)-chlorid und Eisen(II)-chlorid"
- "Eine Erniedrigung der Oxidationszahl einer Atomsorte bei einer Redoxreaktion bedeutet, dass diese Atomsorte reduziert wurde; analog bedeutet eine Erhöhung der Oxidationszahl einer Atomsorte, dass diese Atomsorte oxidiert wurde." --> Das ist unkorrekt formuliert, da, wie eingangs erwähnt, die Oxidationszahl ein formalistisches Modell ist und keine direkte wissenschaftliche Entsprechung hat. Eine evt. richtige Formulierung wäre, dass die Begriffe Oxidation und Reduktion so definiert sind.
Der Artikel benennt ferner nicht die wissenschaftlichen Grenzen des Modells, und / oder keine Kritik an diesem Modell. --2A0A:A545:EFBC:0:2ADD:4635:AF40:72E6 17:09, 1. Jan. 2022 (CET)

