Ethylisothiocyanat
Zur Navigation springen
Zur Suche springen
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
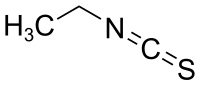
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Ethylisothiocyanat | ||||||||||||||||||
| Andere Namen |
Ethylsenföl | ||||||||||||||||||
| Summenformel | C3H5NS | ||||||||||||||||||
| Kurzbeschreibung |
hellgelbe, klare Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 87,14 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||||||||
| Dichte |
0,995 g·cm−3 (25 °C)[1] | ||||||||||||||||||
| Schmelzpunkt |
−6 °C[1] | ||||||||||||||||||
| Siedepunkt |
130–132 °C[1] | ||||||||||||||||||
| Löslichkeit |
7,02 g·l−1 bei 25 °C in Wasser[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Ethylisothiocyanat ist eine chemische Verbindung aus der Gruppe der Isothiocyanate.
Vorkommen[Bearbeiten | Quelltext bearbeiten]

Im Vergleich mit anderen Isothiocyanaten ist Ethylisothiocyanat in der Natur wenig verbreitet. Es kommt in den Samen der Virginischen Kresse vor.[3]
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Ethylisothiocyanat kann durch eine Hofmannsche Senfölreaktion von Ethylamin mit Kohlenstoffdisulfid und Quecksilber(II)-chlorid gewonnen werden.[4] Ebenfalls möglich ist die Darstellung durch Reaktion von N,N'-Diethylthioharnstoff mit Ethylamin.[5]
Verwendung[Bearbeiten | Quelltext bearbeiten]
Ethylisothiocyanat kann zur Synthese von Heterocyclen dienen, beispielsweise von 2,3-Dihydropyridinen.[6]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f g Datenblatt Ethyl-isothiocyanat bei Sigma-Aldrich, abgerufen am 10. Juni 2023 (PDF).
- ↑ Eintrag zu Ethylisothiocyanat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Juni 2023. (JavaScript erforderlich)
- ↑ Anders Kjær, Ivan Larsen, Erling Tjus, R. H. Burris: isoThiocyanates. IX. The Occurrence of Ethyl isoThiocyanate in Nature. In: Acta Chemica Scandinavica. Band 8, 1954, S. 699–701, doi:10.3891/acta.chem.scand.08-0699.
- ↑ R. L. Madan: Organic Reactions Conversions Mechanisms & Problems. S. Chand Limited, 2009, ISBN 978-81-219-2038-4, S. 50 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Henry Watts, George Fownes, Sir William Augustus Tilden: Watts' Manual of Chemistry, Theoretical and Practical. P. Blakiston, 1886, S. 114 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Lambert Brandsma, Nina A. Nedolya, Hermann D. Verkruijsse, Noel L. Owen, Li Du, Boris A. Trofimov: Synthesis of 2,3-dihydropyridines, cyclobutanopyrrolines and quinolines from lithiated allenes and isothiocyanates. In: Tetrahedron Letters. Band 38, Nr. 39, September 1997, S. 6905–6908, doi:10.1016/S0040-4039(97)01591-8.




