Gemini-Tenside
Gemini-Tenside (gemini, lateinisch „Zwillinge“) sind grenzflächenaktive Substanzen und quasi Dimere konventioneller Tenside, die über eine als „Spacer“ (Abstandshalter) bezeichnete Molekülbrücke verknüpft sind. Die auch als Zwillings- oder Dimer-Tenside bezeichneten Amphiphile weisen neben zwei hydrophoben Kohlenwasserstoffketten (CnH2n+1 mit n ≥ 8) zwei hydrophile Kopfgruppen auf.
Allgemeines[Bearbeiten | Quelltext bearbeiten]
Unabhängig von Größe, Polarität und Ladung – anionisch, kationisch, nichtionisch oder amphoter – zeigen Gemini-Tenside oft um mehrere Größenordnungen kleinere CMC und meist auch deutlich geringere Grenzflächen- und Oberflächenspannungen.[1]

Unsymmetrische Gemini-Tenside weisen bei verdoppelter Tensidmolekülstruktur unterschiedliche hydrophobe und hydrophile Molekülteile auf, während die so genannten Bolaamphiphile (Bola nach dem Wurfgerät südamerikanischer Rinderhirten) am Ende einer langen hydrophoben Kette je eine hydrophile Kopfgruppe besitzen.

Grundlegende Beiträge über Gemini-Tenside stammen von Fredric M. Menger[2][3] und Milton J. Rosen.[1][4]
Synthese[Bearbeiten | Quelltext bearbeiten]
Gemini-Tenside wurden erstmals 1971 als „dikationische Detergentien“ beschrieben,[5] die bei der Umsetzung von Tetramethyldiaminen vom Typ Tetramethylethylendiamin TMEDA und seiner Homologen durch Quaternisierung mit 1-Bromhexadecan (Cetylbromid) entstehen.

Das gebildete kationische Gemini-Tensid als quasi verdoppeltes Cetyltrimethylammoniumbromid CTAB bildet bei niedrigen Konzentrationen Mizellen, die die alkalische Hydrolyse von 2,4-Dinitrochlorbenzol um bis zu vierfach besser katalysieren als durch Mizellen des „monomeren“ CTAB.
Einen einfachen Zugang zu anionischen Gemini-Tensiden mit Carboxygruppen in der hydrophilen Kopfgruppe eröffnet der Komplexbildner Ethylendiamin-N,N‘-diessigsäure – zugänglich aus Ethylendiamin, Formaldehyd und Cyanwasserstoff[6][7] – als Ausgangsstoff, der in einer Schotten-Baumann-Reaktion in Wasser/Isopropanol mit Carbonsäurechloriden, wie z. B. Lauroylchlorid, mit Ausbeuten bis 87 % zum Diamid bzw. zur N,N‘-Diacyldiaminosäure acyliert wird.

Im Gegensatz zu konventionellen Tensiden erfordert die Synthese von Zwillingstensiden jedoch meist mehrstufige Prozesse mit für industrielle Verfahren unbefriedigenden Gesamtausbeuten.[8] Beispielhaft für eine Gemini-Synthese wird das als Spacer fungierende Ethylendiamin zunächst mit Kokosmethylester (Gemisch überwiegend aus Laurinsäuremethylester C12 und Myristinsäuremethylester C14) unter Methanolabspaltung diacyliert und das entstandene Diamid (ca. 85 % Ausbeute) praktisch quantitativ ethoxyliert. Die Menge des eingesetzten Ethylenoxids EO bestimmt die Anzahl der eingebauten EO- bzw. Polyethylenglykol PEG-Einheiten. Das Ethoxylat wird anschließend mit einem Gemisch aus Chlorsulfonsäure ClSO3H und Essigsäure sulfatiert (ca. 36 bis 62 % Ausbeute) und mit Natriumcarbonat in das Natriumsalz überführt.
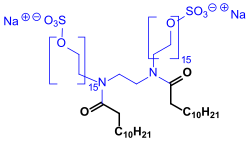
Nach diesem Prozess ist auch die kommerzielle Verbindung Natriumdicocoylethylendiamin-PEG 15-sulfat (Gemini-Komponente in Ceralution® ES der Firma Sasol, früher RWE-DEA) erhältlich.[9]
Relativ einfach und mit hohen Ausbeuten sind hydrophile Gemini-Tenside unter Einsatz nachwachsender Rohstoffe, wie z. B. Glucose und Glycerin zugänglich. So kann das aus Dodecylamin und Glucose unter reduzierenden Bedingungen gebildete N-Dodecylglucamin mit Diepoxiden, wie z. B. 1,2,7,8-Diepoxyoctan, quantitativ zum Dimertensid umgesetzt werden.[10] Ein Vergleich der kritischen Tensideigenschaften von Gemini- und Monomer-Tensid zeigt die wesentlich höhere Wasserlöslichkeit und Oberflächenaktivität des Gemini-Tensids mit signifikant niedrigerer CMC- und C20-Werten (Tensidkonzentration, die die Oberflächenspannung um 20 mNm−1 reduziert).

Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Die ungewöhnlichen Grenzflächeneigenschaften von Gemini-Tensiden in wässrigen Medien beruhen auf der – im Vergleich zu herkömmlichen (monomeren) Tensiden – höheren Zahl hydrophober Methylengruppen pro Molekül. Dadurch wird die Wasserstruktur stärker gestört, Tensidmoleküle in die Gas-Wasser-Grenzfläche gedrängt und so der so genannte hydrophoben Effekt, die Bildung von Tensidaggregaten, wie Mizellen oder lyotrope Flüssigkristallphasen begünstigt. Die geringere Löslichkeit von dimeren Tensiden in Wasser wird durch die zwei hydrophilen Kopfgruppen im Molekül kompensiert, woraus hohe Grenzflächenaktivität (mit drastischer Verringerung der Grenzflächenspannung) und sehr niedrige kritische Mizellbildungskonzentration CMC der Zwillingstenside resultieren.[4] Daher genügen bereits sehr geringe Tensidkonzentrationen zur deutlichen Erniedrigung der Oberflächenspannung σ von Wasser (72,75 mN/m bei 20 °C). Flexible Spacer, wie Polymethylen- oder Polyethylenoxidketten, erhöhen die Grenzflächenaktivität von Gemini-Tensiden.
Zwillingstenside zeigen ein sehr komplexes Phasenverhalten in wässrigen Medien, das nicht nur von den Moleküleigenschaften, wie Länge der hydrophoben Ketten, Spacerstrukturen und -längen, Polarität, Ladung und Größe der hydrophilen Kopfgruppen abhängt, sondern auch von äußeren Parametern, wie Konzentration, Temperatur, Ionenstärke und Gegenwart anderer grenzflächenaktiver Substanzen im Medium. Oberhalb der CMC können unterschiedliche Molekülaggregate vorliegen, wie z. B. sphärische, stäbchenförmige oder auch wurmartige Mizellen.[11]
Hydrotrope Substanzen, beispielsweise organische Anionen, wie sie für die Solubilisierung von Tensiden in wässrigen Formulierungen verwendet werden, üben synergistische Effekte auf kationische Gemini-Tenside aus, indem sie die kritische Mizellbildungskonzentration CMC und die Oberflächenspannung bei der CMC stark erniedrigen und wässrige Lösungen verdicken.[12]
Die Bioabbaubarkeit von Gemini-Tensiden ist in der Regel weniger gut als die ihrer monomeren Varianten. Durch Einbau funktioneller Gruppen, wie Carboxyl- oder Sulfatgruppen, bzw. spaltbarer Molekülfunktionen, wie Ether, Ester oder Amide, soll der mikrobielle Abbau dieser Tenside erleichtert werden. Allerdings sind kommerzielle Dimertenside aus der Surfynol® 400-Reihe (ethoxyliertes TMDD 2,4,7,9-Tetramethyl-5-decin-4,7-diol) als nicht leicht biologisch abbaubar beschrieben. Das Grundgerüst TMDD wird auch in Kläranlagen praktisch nicht abgebaut und inzwischen in vielen Oberflächengewässern, wie z. B. im Rhein, als Verunreinigung gefunden.[13]

Anwendungen[Bearbeiten | Quelltext bearbeiten]
Wässrige Lösungen, die Gemini-Tenside in sehr niedrigen (z. B. 0,1 Gewichtsprozent) Konzentrationen enthalten, weisen extrem kleine Kontaktwinkel auf und zeigen sehr gute Benetzung von hydrophoben Oberflächen mit niedrigen Oberflächenenergien, wie z. B. aus Polyethylen PE oder Polycarbonat PC. Diese auch als engl. superwetting Effekt bezeichnete Eigenschaft ermöglicht rasche Spreitung von Beschichtungen, Druckfarben und Klebstoffen auf wässriger Basis und vollständige Bedeckung von schwer benetzbaren, z. B. vorlackierten oder auch kontaminierten Substraten. Dabei vermeiden Gemini-Tenside die Nachteile teurer Perfluorcarbonsäuren, wie Perfluoroctansäure und Silicontenside (funktionelle Silicone), die wegen ihrer Persistenz bzw. oft schlechten Verlaufseigenschaften problematisch sind.
Gemini-Tenside diffundieren rasch in neu gebildete Wasser/Luft-Grenzflächen und unterdrücken so effizient die Schaumbildung bzw. zerstören Schaumblasen (Entschäumerwirkung).
In technischen Anwendungen, wie z. B. als Dispergiermittel zur Herstellung von Zubereitungen für Farben und Pigmente, sowie für Pflanzenschutzmittel werden Dimertenside ebenso eingesetzt wie als Emulgatoren und Korrosionsschutzmittel in Kühlschmiermitteln, bei der Öl- und Gasaufbereitung und zur Formulierung von Pflanzenschutzmittel.
Dikationische Zwillingstenside zeichnen sich durch starke antimikrobielle Wirksamkeit aus, die der entsprechender „monomerer“ Quats überlegen ist.
Auch in Körperpflege- und Kosmetikprodukten[14] sind Zwillingstenside als Emulgatoren wegen ihrer außerordentlich hohen Oberflächenaktivität und Kompatibilität mit anderen Komponenten in flüssigen und halbfesten Zubereitungen besonders vorteilhaft. Gemini-Tenside werden oft zusammen mit Co-Tensiden (Ceteareth-25 bei Ceralution® ES) kombiniert, welche die Dosierung vereinfachen, das Mischungsverhalten begünstigen und die Anwendungseigenschaften verbessern.
Gemini-Tenside wurden in einigen technischen Anwendungen eingeführt, konnten sich aber bisher wegen ihrer vergleichsweise aufwendigen und daher teuren Synthese, der hohen aquatischen Toxizität und schlechten Bioabbaubarkeit nicht auf breiter Front am Markt etablieren. Fredric Menger’s Vorhersage aus dem Jahr 2000: „Nach Meinung einiger könnte sich sehr wohl herausstellen, dass Gemini‐Tenside für „Otto Normalverbraucher“ nützlicher sind als Kronenether oder Fullerene“ hat sich bis jetzt noch nicht bestätigt.
Literatur[Bearbeiten | Quelltext bearbeiten]
- Milton J. Rosen, Joy T. Kunjappu: Surfactants and Interfacial Phenomena. John Wiley & Sons, Hoboken, NJ, 2012, ISBN 978-1-118-22902-6
- Fredric M. Menger, Jason S. Keiper: Gemini-Tenside. In: Angewandte Chemie. 112(11), S. 1980–1996 (2000), doi:10.1002/1521-3757(20000602)112:11<1980::AID-ANGE1980>3.0.CO;2-D
- Bogumil E. Brycki, Iwona H. Kowalczyk, Adrianna Szulc, Olga Kaczerewska and Marta Pakiet: Multifunctional Gemini Surfactants: Structure, Synthesis, Properties and Applications. In: Intechopen. (2017), DOI:10.5577/intchopen.68755
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b M.J. Rosen, D.J. Tracy: Gemini surfactants. In: J. Surf. Deter. Band 1, Nr. 4, 1998, S. 547–554, doi:10.1007/s11743-998-0059-8.
- ↑ F.M. Menger, C.A. Littau: Gemini-surfactants: synthesis and properties. In: J. Amer. Chem. Soc. Band 113, Nr. 4, 1991, S. 1451–1452, doi:10.1021/ja00004a077.
- ↑ F.M. Menger, C.A. Littau: Gemini surfactants: a new class of self-assembling molecules. In: J. Amer. Chem. Soc. Band 115, Nr. 22, 1993, S. 10083–10090, doi:10.1021/ja00075a025.
- ↑ a b M.J. Rosen: Geminis: A new generation of surfactants. In: CHEMTECH. Band 23, Nr. 3, 1993, ISSN 0009-2703, S. 30–33.
- ↑ C.A. Bunton, L. Robinson, J. Schaak, M.F. Stam: Catalysis of nucleophilic substitution by micelles of dicationic detergents. In: J. Org. Chem. Band 36, Nr. 11, 1971, S. 2346–2350, doi:10.1021/jo00815a033.
- ↑ Patent US2387735: Method of forming carboxylic amino acids. Angemeldet am 3. Juli 1941, veröffentlicht am 30. Oktober 1945, Anmelder: The Martin Dennis Co., Erfinder: F.C. Bersworth.
- ↑ Patent US2558923: Process of purifying ethylene diamine di-acetic acid. Angemeldet am 12. Mai 1948, veröffentlicht am 3. Juli 1951, Anmelder: N.N., Erfinder: F.C. Bersworth.
- ↑ Patent DE4440328A1: Amphiphile Verbindungen mit mindestens zwei hydrophilen und mindestens zwei hydrophoben Gruppen auf der Basis von Amiden. Angemeldet am 11. November 1994, veröffentlicht am 15. Mai 1996, Anmelder: Hüls AG, Erfinder: K. Kwetkat, W. Ruback.
- ↑ Patent WO0119945A1: Tensidzusammensetzung enthaltend Geminitenside und Co-Amphiphile, ihre Herstellung und ihre Verwendung. Angemeldet am 13. September 2000, veröffentlicht am 22. März 2001, Anmelder: RWE-DEA AG für Mineralöl und Chemie, Erfinder: G.H. Dahms, K. Kwetkat.
- ↑ S. Warwel, F. Brüse, H. Schier, B. Wiege: Gemini-Tenside aus langkettigen N-Alkylaminen und Diepoxiden von α,ω-Diolefinen. In: Nachwachsende Rohstoffe für die Chemie – 8. Symposium Tübingen. 2003, S. 478–482 (openagrar.de).
- ↑ Q. Li, X. Wang, X. Yue, X. Chen: Wormlike micelles formed using Gemini surfactants with quaternary hydroxyethyl methylammonium headgroups. In: Soft Matter. Band 9, Nr. 40, 2013, S. 9667–9674, doi:10.1039/C3SM51722E.
- ↑ L. Wattebled, A. Laschewsky: Effects of organic salt additives on the behavior of dimeric (“gemini”) surfactants in aqueous solution. In: Langmuir. Band 23, Nr. 20, 2007, S. 10044–10052, doi:10.1021/la701542k.
- ↑ A.A. Guedez, S. Frömmel, P. Diehl, W. Püttmann: Occurrence and temporal variations of TMDD in the river Rhine, Germany. In: Environ. Sci. Poll. Res. Int. Band 2, 2010, S. 321–330, doi:10.1007/s11356-009-0191-8.
- ↑ N. Kumar, R. Tyagi: Review: Dimeric Surfactants: Promising Ingredients of Cosmetics and Toiletries. In: Cosmetics. Band 1, 2014, S. 3–11, doi:10.3390/cosmetics1010003.